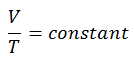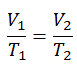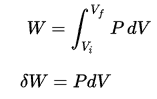Processo Isobárico – Equação Ideal de Gás
Veja também: O que é um gás ideal
Vamos assumir uma adição isobárica de calor em um gás ideal. Num gás ideal , as moléculas não têm volume e não interagem. De acordo com a lei ideal dos gases , a pressão varia linearmente com a temperatura e a quantidade e inversamente com o volume .
pV = nRT
Onde:
- p é a pressão absoluta do gás
- n é a quantidade de substância
- T é a temperatura absoluta
- V é o volume
- R é a constante de gás ideal, ou universal, igual ao produto da constante de Boltzmann e da constante de Avogadro,
Nesta equação, o símbolo R é uma constante chamada constante universal de gás que tem o mesmo valor para todos os gases – ou seja, R = 8,31 J / mol K.
O processo isobárico pode ser expresso com a lei do gás ideal como:
ou
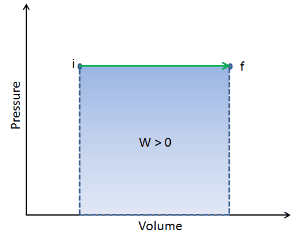
Em um diagrama de pV , o processo ocorre ao longo de uma linha horizontal (chamada isobar) que possui a equação p = constante.
O trabalho de volume de pressão pelo sistema fechado é definido como:
Assumindo que a quantidade de gás ideal permaneça constante e aplicando a lei do gás ideal , isso se torna
De acordo com o modelo de gás ideal, a energia interna pode ser calculada por:
∆U = mc v ∆T
onde a propriedade c v (J / mol K) é referida como calor específico (ou capacidade de calor ) a um volume constante porque, sob certas condições especiais (volume constante), relaciona a mudança de temperatura de um sistema à quantidade de energia adicionada por transferência de calor.
Somando essas equações, obtemos a equação para o calor:
Q = mc v ∆T + mR ∆T = m (c v + R) ∆T = m c p ∆T
onde a propriedade c p (J / mol K) é referido como calor específico (ou capacidade de calor ) a uma pressão constante.
Veja também: Calor específico a volume constante e pressão constante
Veja também: Fórmula de Mayer

Lei de Charles
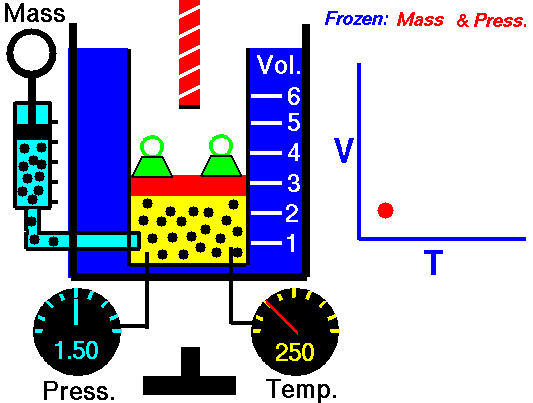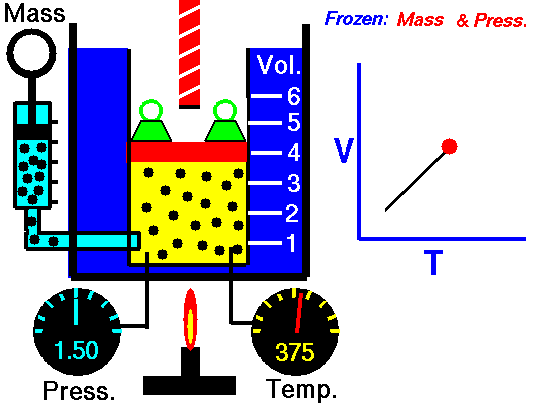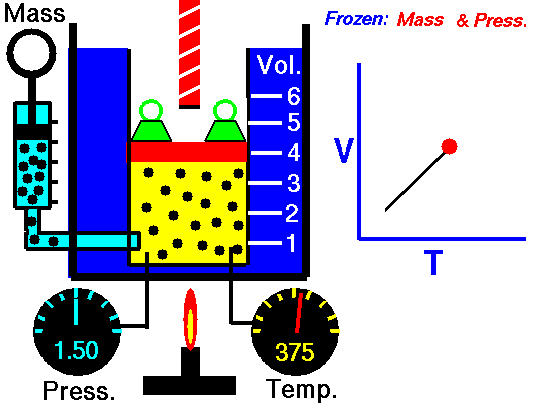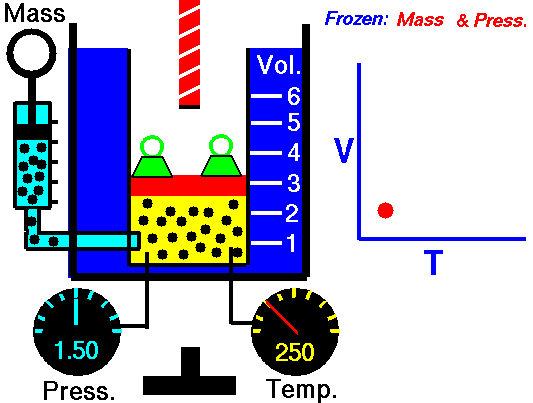
A lei de Charles é uma das leis de gás. No final do século XVIII, o inventor e cientista francês Jacques Alexandre César Charles estudou a relação entre o volume e a temperatura de um gás sob pressão constante . Os resultados de certas experiências com gases sob pressão relativamente baixa levaram Jacques Alexandre César Charles a formular uma lei bem conhecida. Afirma que:
Para uma massa fixa de gás a pressão constante, o volume é diretamente proporcional à temperatura Kelvin.
Isso significa que, por exemplo, se você dobrar a temperatura, dobrará o volume. Se você reduzir pela metade a temperatura, reduzirá pela metade o volume.
Você pode expressar isso matematicamente como:
V = constante. T
Sim, parece ser idêntico ao processo isobárico do gás ideal. Esses resultados são totalmente consistentes com a lei ideal dos gases , que determina que a constante é igual a nR / p . Se você reorganizar a equação pV = nRT dividindo os dois lados por p, obterá:
V = nR / p. T
onde nR / p é constante e:
- p é a pressão absoluta do gás
- n é a quantidade de substância
- T é a temperatura absoluta
- V é o volume
- R é a constante de gás ideal, ou universal, igual ao produto da constante de Boltzmann e da constante de Avogadro,
Nesta equação, o símbolo R é uma constante chamada constante universal de gás que tem o mesmo valor para todos os gases – ou seja, R = 8,31 J / mol K.
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.