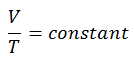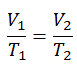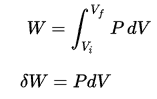Proceso isobárico: ecuación de gas ideal
Ver también: ¿Qué es un gas ideal?
Supongamos una adición de calor isobárico en un gas ideal. En un gas ideal , las moléculas no tienen volumen y no interactúan. Según la ley de los gases ideales , la presión varía linealmente con la temperatura y la cantidad, e inversamente con el volumen .
pV = nRT
dónde:
- p es la presión absoluta del gas
- n es la cantidad de sustancia
- T es la temperatura absoluta
- V es el volumen
- R es la constante de gas ideal, o universal, igual al producto de la constante de Boltzmann y la constante de Avogadro,
En esta ecuación, el símbolo R es una constante llamada constante de gas universal que tiene el mismo valor para todos los gases, es decir, R = 8.31 J / mol K.
El proceso isobárico se puede expresar con la ley de los gases ideales como:
o
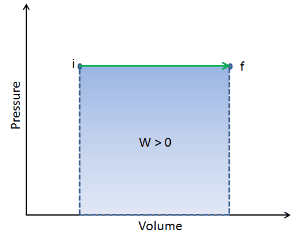
En un diagrama pV , el proceso ocurre a lo largo de una línea horizontal (llamada isobar) que tiene la ecuación p = constante.
El trabajo de presión-volumen del sistema cerrado se define como:
Suponiendo que la cantidad de gas ideal permanece constante y aplicando la ley del gas ideal , esto se convierte en
Según el modelo de gas ideal, la energía interna se puede calcular mediante:
∆U = mc v ∆T
donde la propiedad c v (J / mol K) se denomina calor específico (o capacidad calorífica ) a un volumen constante porque, bajo ciertas condiciones especiales (volumen constante), relaciona el cambio de temperatura de un sistema con la cantidad de energía agregada por transferencia de calor.
Al sumar estas ecuaciones, obtenemos la ecuación para el calor:
Q = mc v ∆T + m R ∆T = m (c v + R) ∆T = m c p ∆T
donde la propiedad c p (J / mol K) se denomina calor específico (o capacidad calorífica ) a una presión constante.
Ver también: Calor específico a volumen constante y presión constante
Ver también: fórmula de Mayer
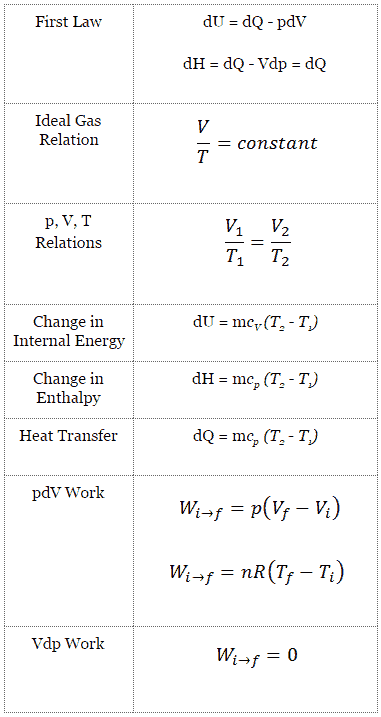
Ley de Charles
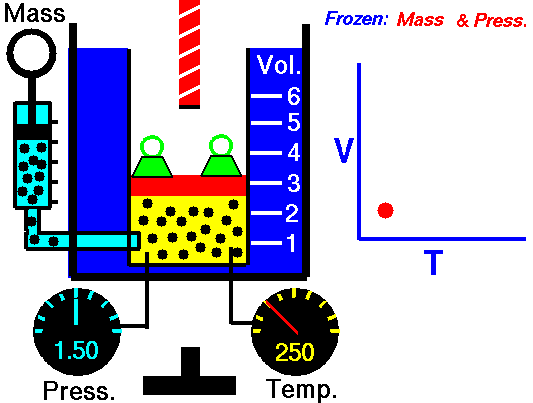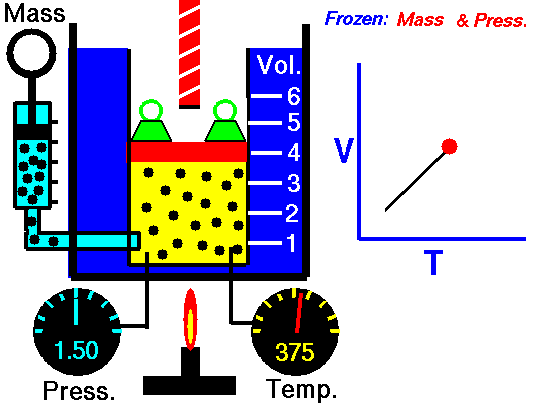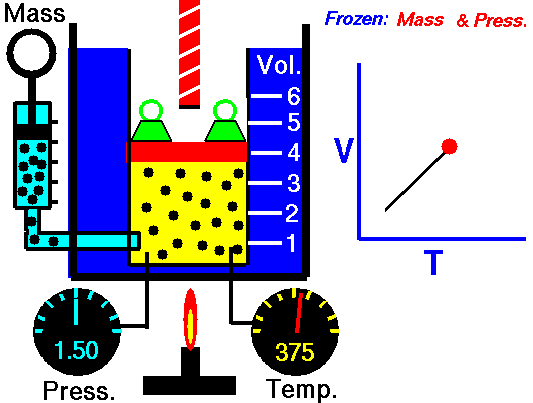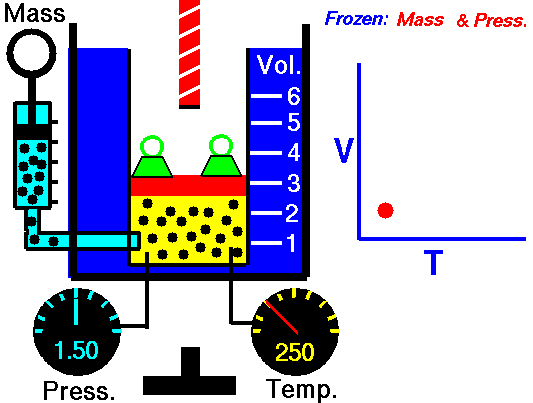
La Ley de Charles es una de las leyes del gas. A finales del siglo XVIII, el inventor y científico francés Jacques Alexandre César Charles estudió la relación entre el volumen y la temperatura de un gas a presión constante . Los resultados de ciertos experimentos con gases a una presión relativamente baja llevaron a Jacques Alexandre César Charles a formular una ley bien conocida. Se afirma que:
Para una masa fija de gas a presión constante, el volumen es directamente proporcional a la temperatura Kelvin.
Eso significa que, por ejemplo, si duplica la temperatura, duplicará el volumen. Si reduce a la mitad la temperatura, reducirá a la mitad el volumen.
Puede expresar esto matemáticamente como:
V = constante. T
Sí, parece ser idéntico al proceso isobárico del gas ideal. Estos resultados son totalmente consistentes con la ley del gas ideal , que determina que la constante es igual a nR / p . Si reorganiza la ecuación pV = nRT dividiendo ambos lados por p, obtendrá:
V = nR / p. T
donde nR / p es constante y:
- p es la presión absoluta del gas
- n es la cantidad de sustancia
- T es la temperatura absoluta
- V es el volumen
- R es la constante de gas ideal, o universal, igual al producto de la constante de Boltzmann y la constante de Avogadro,
En esta ecuación, el símbolo R es una constante llamada constante de gas universal que tiene el mismo valor para todos los gases, es decir, R = 8.31 J / mol K.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.