Energía microscópica
La energía interna implica energía a escala microscópica . Se puede dividir en energía potencial microscópica, U pot , y energía cinética microscópica, U kin , componentes:
U = U pot + U kin
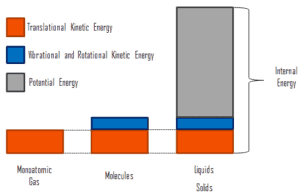 donde la energía cinética microscópica, U kin , involucra los movimientos de todas las partículas del sistema con respecto al marco del centro de masa. Para un gas monoatómico ideal , esto es solo la energía cinética traslacional del movimiento lineal de los átomos. Las partículas monoatómicas no giran ni vibran. El comportamiento del sistema está bien descrito por la teoría cinética de los gases. La teoría cinética se basa en el hecho de que durante una colisión elástica entre una molécula con alta energía cinética y otra con baja energía cinética, parte de la energía se transferirá a la molécula de menor energía cinética. Sin embargo, para los gases poliatómicos hay rotación yenergía cinética vibracional también.
donde la energía cinética microscópica, U kin , involucra los movimientos de todas las partículas del sistema con respecto al marco del centro de masa. Para un gas monoatómico ideal , esto es solo la energía cinética traslacional del movimiento lineal de los átomos. Las partículas monoatómicas no giran ni vibran. El comportamiento del sistema está bien descrito por la teoría cinética de los gases. La teoría cinética se basa en el hecho de que durante una colisión elástica entre una molécula con alta energía cinética y otra con baja energía cinética, parte de la energía se transferirá a la molécula de menor energía cinética. Sin embargo, para los gases poliatómicos hay rotación yenergía cinética vibracional también.
La energía potencial microscópica, U pot , involucra los enlaces químicos entre los átomos que forman las moléculas, las fuerzas de unión en el núcleo y también los campos de fuerza física dentro del sistema (por ejemplo, campos eléctricos o magnéticos).
En líquidos y sólidos hay un componente significativo de energía potencial asociado con las fuerzas de atracción intermoleculares .
Energía interna específica
La energía interna específica (u) de una sustancia es su energía interna por unidad de masa. Es una propiedad intensiva . Es igual a la energía interna total (U) dividida por la masa total (m).
u = U / m
dónde:
u = energía interna específica (J / kg)
U = energía interna (J)
m = masa (kg)
Energía interna de un gas ideal
Gas monoatómico
Para un gas ideal monoatómico (como helio, neón o argón), la única contribución a la energía proviene de la energía cinética traslacional . La energía cinética traslacional promedio de un solo átomo depende solo de la temperatura del gas y está dada por la ecuación
K promedio = 3/2 kT.
La energía interna de n moles de un gas ideal monoatómico (un átomo por molécula) es igual a la energía cinética promedio por molécula multiplicada por el número total de moléculas, N:
E int = 3/2 NkT = 3/2 nRT
donde n es el número de moles. Cada dirección (x, y y z) contribuye (1/2) nRT a la energía interna. Aquí es donde entra en juego la idea de equipartición de energía: cualquier otra contribución a la energía también debe contribuir (1/2) nRT. Como se puede ver, la energía interna de un gas ideal depende solo de la temperatura y la cantidad de moles de gas.
Molécula Diatómica
Si las moléculas de gas contienen más de un átomo, hay tres direcciones de traslación , y la energía cinética rotacional también contribuye, pero solo para rotaciones alrededor de dos de los tres ejes perpendiculares. Las cinco contribuciones a la energía (cinco grados de libertad) dan:
Gas ideal diatómico:
E int = (5/2) NkT = (5/2) nRT
Esto es solo una aproximación y se aplica a temperaturas intermedias. A bajas temperaturas solo contribuye la energía cinética traslacional, y a temperaturas más altas dos vibraciones aportan dos contribuciones adicionales (energía cinética y potencial).
La energía interna será mayor a una temperatura dada que para un gas monoatómico, pero seguirá siendo función solo de la temperatura para un gas ideal.
La energía interna de los gases reales también depende principalmente de la temperatura, pero de manera similar a la Ley del Gas Ideal , la energía interna de los gases reales también depende en cierta medida de la presión y el volumen. Todos los gases reales se aproximan al estado ideal a bajas presiones (densidades). A bajas presiones, las moléculas están lo suficientemente separadas como para que no interactúen entre sí. La energía interna de líquidos y sólidos es bastante complicada, ya que incluye la energía potencial eléctrica asociada con las fuerzas (o enlaces “químicos”) entre átomos y moléculas.
Energía interna y la primera ley de la termodinámica.
En termodinámica, el concepto de energía se amplía para tener en cuenta otros cambios observados, y el principio de conservación de la energía se extiende para incluir una amplia variedad de formas en que los sistemas interactúan con su entorno. Las únicas formas en que se puede cambiar la energía de un sistema cerrado son mediante la transferencia de energía por trabajo o por calor . Además, según los experimentos de Joule y otros, un aspecto fundamental del concepto de energía es que la energía se conserva. Este principio se conoce como la primera ley de la termodinámica . La primera ley de la termodinámica se puede escribir en varias formas:
En palabras:
Forma de ecuación:
IntE int = Q – W
donde E int representa la energía interna del material, que depende solo del estado del material (temperatura, presión y volumen). Q es el calor neto agregado al sistema y W es el trabajo neto realizado por el sistema. Debemos ser cuidadosos y consistentes al seguir las convenciones de signos para Q y W. Como W en la ecuación es el trabajo realizado por el sistema, entonces si el trabajo se realiza en el sistema, W será negativo y E int aumentará.
Del mismo modo, Q es positivo para el calor agregado al sistema, por lo que si el calor abandona el sistema, Q es negativo. Esto nos dice lo siguiente: la energía interna de un sistema tiende a aumentar si el sistema absorbe calor o si se realiza un trabajo positivo en el sistema. Por el contrario, la energía interna tiende a disminuir si el sistema pierde calor o si se realiza un trabajo negativo en el sistema. Debe agregarse que Q y W dependen de la ruta, mientras que E int es independiente de la ruta.
Forma diferencial:
dE int = dQ – dW
La energía interna E int de un sistema tiende a aumentar si se agrega energía como calor Q y tiende a disminuir si se pierde energía como trabajo W realizado por el sistema.
Vea también: Sistema abierto – Sistema cerrado – Sistema aislado
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.
