Energia microscópica
A energia interna envolve energia na escala microscópica . Pode ser dividido em energia microscópica potencial, pote U e energia cinética microscópica, U kin , componentes:
U = U pote + U parentes
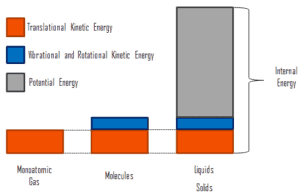 onde a energia cinética microscópica, U kin , envolve os movimentos de todas as partículas do sistema em relação à estrutura do centro de massa. Para um gás monatômico ideal , essa é apenas a energia cinética translacional do movimento linear dos átomos. Partículas monoatômicas não giram ou vibram. O comportamento do sistema é bem descrito pela teoria cinética dos gases. A teoria cinética baseia-se no fato de que durante uma colisão elástica entre uma molécula com alta energia cinética e outra com baixa energia cinética, parte da energia será transferida para a molécula de energia cinética inferior. No entanto, para gases poliatômicos, existem rotações eenergia cinética vibracional também.
onde a energia cinética microscópica, U kin , envolve os movimentos de todas as partículas do sistema em relação à estrutura do centro de massa. Para um gás monatômico ideal , essa é apenas a energia cinética translacional do movimento linear dos átomos. Partículas monoatômicas não giram ou vibram. O comportamento do sistema é bem descrito pela teoria cinética dos gases. A teoria cinética baseia-se no fato de que durante uma colisão elástica entre uma molécula com alta energia cinética e outra com baixa energia cinética, parte da energia será transferida para a molécula de energia cinética inferior. No entanto, para gases poliatômicos, existem rotações eenergia cinética vibracional também.
A energia potencial microscópica, U pot , envolve as ligações químicas entre os átomos que compõem as moléculas, as forças de ligação no núcleo e também os campos de força física no sistema (por exemplo, campos elétricos ou magnéticos).
Em líquidos e sólidos, há um componente significativo da energia potencial associada às forças de atração intermoleculares .
Energia interna específica
A energia interna específica (u) de uma substância é sua energia interna por unidade de massa. É uma propriedade intensiva . É igual à energia interna total (U) dividida pela massa total (m).
u = U / m
Onde:
u = energia interna específica (J / kg)
U = energia interna (J)
m = massa (kg)
Energia interna de um gás ideal
Gás Monatômico
Para um gás ideal monatômico (como hélio, néon ou argônio), a única contribuição para a energia vem da energia cinética translacional . A energia cinética translacional média de um único átomo depende apenas da temperatura do gás e é dada pela equação
K méd = 3/2 kT.
A energia interna de n moles de um gás monatômico ideal (um átomo por molécula) é igual à energia cinética média por molécula vezes o número total de moléculas, N:
E int = 3/2 NkT = 3/2 nRT
onde n é o número de moles. Cada direção (x, ye z) contribui (1/2) nRT para a energia interna. É aqui que entra a idéia da equipartição de energia – qualquer outra contribuição para a energia também deve contribuir (1/2) nRT. Como pode ser visto, a energia interna de um gás ideal depende apenas da temperatura e do número de mols de gás.
Molécula Diatômica
Se as moléculas de gás contêm mais de um átomo, existem três direções de translação e a energia cinética rotacional também contribui, mas apenas para rotações em torno de dois dos três eixos perpendiculares. As cinco contribuições para a energia (cinco graus de liberdade) fornecem:
Gás ideal diatômico:
E int = (5/2) NkT = (5/2) nRT
Esta é apenas uma aproximação e se aplica a temperaturas intermediárias. Em baixas temperaturas, apenas a energia cinética translacional contribui e, em temperaturas mais altas, duas contribuições adicionais (energia cinética e potencial) vêm da vibração.
A energia interna será maior a uma dada temperatura do que para um gás monatômico, mas ainda será uma função apenas da temperatura para um gás ideal.
A energia interna dos gases reais também depende principalmente da temperatura, mas, da mesma forma que a Lei do Gás Ideal , a energia interna dos gases reais também depende um pouco da pressão e do volume. Todos os gases reais se aproximam do estado ideal a baixas pressões (densidades). A baixas pressões, as moléculas estão suficientemente afastadas para que não interajam. A energia interna de líquidos e sólidos é bastante complicada, pois inclui energia potencial elétrica associada às forças (ou ligações “químicas”) entre átomos e moléculas.
Energia Interna e a Primeira Lei da Termodinâmica
Na termodinâmica, o conceito de energia é ampliado para dar conta de outras mudanças observadas, e o princípio de conservação de energia é estendido para incluir uma ampla variedade de maneiras pelas quais os sistemas interagem com seus arredores. As únicas maneiras pelas quais a energia de um sistema fechado pode ser alterada são através da transferência de energia pelo trabalho ou pelo calor . Além disso, com base nos experimentos de Joule e outros, um aspecto fundamental do conceito de energia é que a energia é conservada. Este princípio é conhecido como a primeira lei da termodinâmica . A primeira lei da termodinâmica pode ser escrita de várias formas:
Em palavras:
Forma da equação:
IntE int = Q – W
onde E int representa a energia interna do material, que depende apenas do estado do material (temperatura, pressão e volume). Q é o calor líquido adicionado ao sistema e W é o trabalho líquido realizado pelo sistema. Devemos ser cuidadosos e consistentes ao seguir as convenções de sinal para Q e W. Como W na equação é o trabalho realizado pelo sistema, se o trabalho for realizado no sistema, W será negativo e E int aumentará.
Da mesma forma, Q é positivo para o calor adicionado ao sistema; portanto, se o calor sai do sistema, Q é negativo. Isso nos diz o seguinte: A energia interna de um sistema tende a aumentar se o calor for absorvido pelo sistema ou se um trabalho positivo for feito no sistema. Por outro lado, a energia interna tende a diminuir se o calor for perdido pelo sistema ou se for feito um trabalho negativo no sistema. Deve-se adicionar Q e W dependem do caminho, enquanto E int é independente do caminho.
Forma diferencial:
dE int = dQ – dW
A energia interna E int de um sistema tende a aumentar se a energia é adicionada como calor Q e tende a diminuir se a energia é perdida como o trabalho W realizado pelo sistema.
Vide também: Sistema aberto – Sistema fechado – Sistema isolado
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.
