Fórmula de presión – Ecuación de presión
 La presión es una medida de la fuerza ejercida por unidad de área en los límites de una sustancia. La unidad estándar de presión en el sistema SI es el Newton por metro cuadrado o pascal (Pa) . Matemáticamente (fórmula de presión):
La presión es una medida de la fuerza ejercida por unidad de área en los límites de una sustancia. La unidad estándar de presión en el sistema SI es el Newton por metro cuadrado o pascal (Pa) . Matemáticamente (fórmula de presión):
p = F / A
dónde
- p es la presión
- F es la fuerza normal
- A es el área del límite
Pascal se define como la fuerza de 1N que se ejerce sobre el área de la unidad.
- 1 Pascal = 1 N / m 2
- 1 MPa 10 6 N / m 2
- 1 bar 10 5 N / m 2
- 1 kPa 10 3 N / m 2
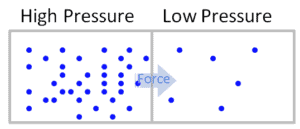
En general, la presión o la fuerza ejercida por unidad de área en los límites de una sustancia es causada por las colisiones de las moléculas de la sustancia con los límites del sistema. Cuando las moléculas golpean las paredes, ejercen fuerzas que intentan empujar las paredes hacia afuera. Las fuerzas resultantes de todas estas colisiones causan la presión ejercida por un sistema en su entorno. La presión como variable intensiva es constante en un sistema cerrado. Realmente solo es relevante en sistemas líquidos o gaseosos.
Ley del gas ideal
Cualquier ecuación que relacione la presión, la temperatura y el volumen específico de una sustancia se llama ecuación de estado . La ecuación de estado más simple y mejor conocida para las sustancias en la fase gaseosa es la ecuación de estado del gas ideal . Émile Clapeyron lo declaró por primera vez en 1834 como una combinación de la ley empírica de Boyle, la ley de Charles y la ley de Avogadro. Esta ecuación predice el comportamiento pvT de un gas con bastante precisión para gases diluidos o de baja presión. En un gas ideal, las moléculas no tienen volumen y no interactúan. Según la ley de los gases ideales, la presión varía linealmente con la temperatura y la cantidad , e inversamente con el volumen .
pV = nRT
dónde:
- p es la presión absoluta del gas
- n es la cantidad de sustancia
- T es la temperatura absoluta
- V es el volumen
- R es la constante de gas ideal, o universal,igual al producto de la constante de Boltzmann y la constante de Avogadro,
En esta ecuación, el símbolo R es una constante llamada constante de gas universal que tiene el mismo valor para todos los gases, es decir, R = 8.31 J / mol K.
El poder de la ley del gas ideal está en su simplicidad . Cuando se dan dos de las variables termodinámicas, p, v y T , se puede encontrar fácilmente la tercera . Un gas ideal se define como uno en el que todas las colisiones entre átomos o moléculas son perfectamente elásticas y en el que no hay fuerzas de atracción intermoleculares. Un gas ideal puede visualizarse como una colección de esferas perfectamente duras que chocan pero que, de lo contrario, no interactúan entre sí. En realidad, ningún gas real es como un gas ideal y, por lo tanto, ningún gas real sigue completamente la ley o ecuación del gas ideal. A temperaturas cercanas al punto de ebullición de los gases, el aumento de la presión provocará la condensación y la disminución drástica del volumen. A presiones muy altas, las fuerzas intermoleculares de un gas son significativas. Sin embargo, la mayoría de los gases están en acuerdo aproximado a presiones y temperaturas superiores a su punto de ebullición.
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.