Um átomo é um espaço vazio?
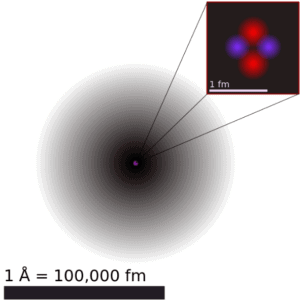
O volume de um átomo é cerca de 15 ordens de grandeza maior que o volume de um núcleo. Para o átomo de urânio , o raio de Van der Waals é de cerca de 186 pm = 1,86 × 10-10 m . O raio de Van der Waals, r w , de um átomo é o raio de uma esfera imaginária disco que representa a distância de aproximação mais próxima para um outro átomo. Assumindo uma forma esférica, o átomo de urânio tem um volume de cerca de 26,9 × 10-30 m 3 . Mas esse espaço “enorme” é ocupado principalmente por elétrons, porque o núcleo ocupa apenas cerca de 1721 × 10-45 m3 de espaço. Esses elétrons juntos pesam apenas uma fração (digamos 0,05%) do átomo inteiro.
Pode parecer que o espaço e, de fato, o assunto esteja vazio , mas não está . Devido à natureza quântica dos elétrons , os elétrons não são partículas pontuais, são espalhados por todo o átomo. A descrição clássica não pode ser usada para descrever coisas na escala atômica. Na escala atômica, os físicos descobriram que a mecânica quântica descreve as coisas muito bem nessa escala. Os locais das partículas na mecânica quântica não estão na posição exata; são descritos por uma função de densidade de probabilidade . Portanto, o espaço em um átomo (entre elétrons e um núcleo atômico) não está vazio, mas é preenchido por uma função de densidade de probabilidade dos elétrons (geralmente conhecida como “ nuvem de elétrons ”).