Un atome est-il un espace vide?
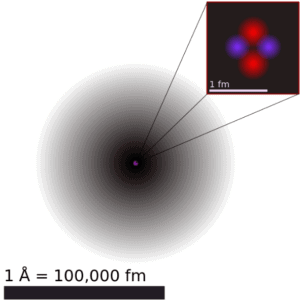
Le volume d’un atome est environ 15 ordres de grandeur plus grand que le volume d’un noyau. Pour l’atome d’uranium , le rayon de Van der Waals est d’environ 186 pm = 1,86 × 10 -10 m . Le rayon de Van der Waals, rw , d’un atome est le rayon d’une sphère dure imaginaire représentant la distance d’approche la plus proche pour un autre atome. En prenant la forme sphérique, l’ atome d’ uranium a un volume d’environ 26,9 × 10 −30 m 3 . Mais cet «immense» espace est principalement occupé par les électrons, car le noyau n’occupe qu’environ 1721 × 10 -45 m3 de l’espace. Ensemble, ces électrons ne pèsent qu’une fraction (disons 0,05%) de l’atome entier.
Il peut sembler que l’espace et la matière sont vides , mais ce n’est pas le cas . En raison de la nature quantique des électrons , les électrons ne sont pas des particules ponctuelles, ils sont étalés sur tout l’atome. La description classique ne peut pas être utilisée pour décrire des choses à l’échelle atomique. À l’échelle atomique, les physiciens ont découvert que la mécanique quantique décrivait très bien les choses à cette échelle. Les emplacements des particules en mécanique quantique ne sont pas à une position exacte, ils sont décrits par une fonction de densité de probabilité . Par conséquent, l’espace dans un atome (entre les électrons et un noyau atomique) n’est pas vide, mais il est rempli par une fonction de densité de probabilité d’électrons (généralement appelée « nuage d’électrons »).