Gasgesetze
Im allgemeinen ist die Gasgesetze sind erste Zustandsgleichungen , die Dichten von Gasen und Flüssigkeiten auf Temperaturen und Drücken zu korrelieren. Die Gasgesetze wurden Ende des 18. Jahrhunderts vollständig ausgearbeitet. Diese Gesetze oder Aussagen gingen dem idealen Gasgesetz voraus , da diese Gesetze einzeln als Sonderfälle der idealen Gasgleichung betrachtet werden, wobei eine oder mehrere der Variablen konstant gehalten werden. Da sie fast vollständig durch die ideale Gasgleichung ersetzt wurden, ist es für Schüler nicht üblich, diese Gesetze im Detail zu lernen. Die ideale Gasgleichung wurde erstmals 1834 von Émile Clapeyron als Kombination dieser Gesetze angegeben:
Boyle-Mariotte-Gesetz
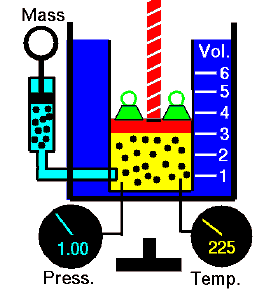
Das Boyle-Mariotte-Gesetz ist eines der Gasgesetze. Ende des 17. Jahrhunderts untersuchten Robert William Boyle und Edme Mariotte unabhängig voneinander die Beziehung zwischen Volumen und Druck eines Gases bei konstanter Temperatur . Die Ergebnisse bestimmter Experimente mit Gasen bei relativ niedrigem Druck veranlassten Robert Boyle, ein bekanntes Gesetz zu formulieren. Es sagt, dass:
Bei einer festen Gasmasse bei konstanter Temperatur ist das Volumen umgekehrt proportional zum Druck.
Das heißt, wenn Sie beispielsweise das Volumen zehnmal erhöhen, sinkt der Druck zehnmal. Wenn Sie das Volumen halbieren, verdoppeln Sie den Druck.
Sie können dies mathematisch ausdrücken als:
pV = konstant
oder
p 1 V 1 = p 2 V 2
Ja, es scheint identisch zu sein mit dem isothermen Prozess des idealen Gases. Tatsächlich bleibt die Temperatur während ihrer Experimente konstant, wie von Mariotte angenommen wurde. Diese Ergebnisse stimmen voll und ganz mit dem idealen Gasgesetz überein , das bestimmt, dass die Konstante gleich nRT ist .
pV = nRT
wo:
- p ist der absolute Druck des Gases
- n ist die Substanzmenge
- T ist die absolute Temperatur
- V ist die Lautstärke
- R ist die ideale oder universelle Gaskonstante, die dem Produkt der Boltzmann-Konstante und der Avogadro-Konstante entspricht.
In dieser Gleichung ist das Symbol R eine Konstante, die als universelle Gaskonstante bezeichnet wird und für alle Gase den gleichen Wert hat, nämlich R = 8,31 J / mol K.
Bei einer festen Gasmasse bei konstanter Temperatur ist das Volumen umgekehrt proportional zum Druck. Quelle: grc.nasa.gov Die NASA-Urheberrechtsrichtlinie besagt, dass „NASA-Material nicht urheberrechtlich geschützt ist, sofern nicht anders angegeben“
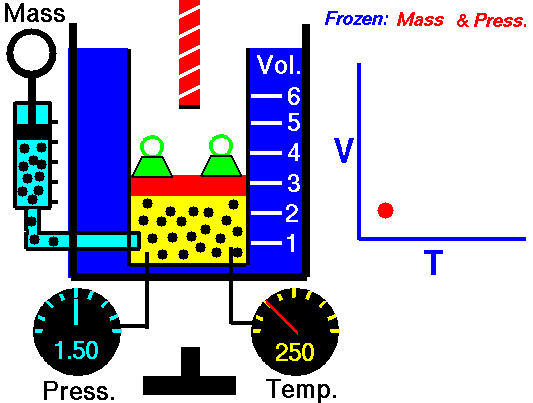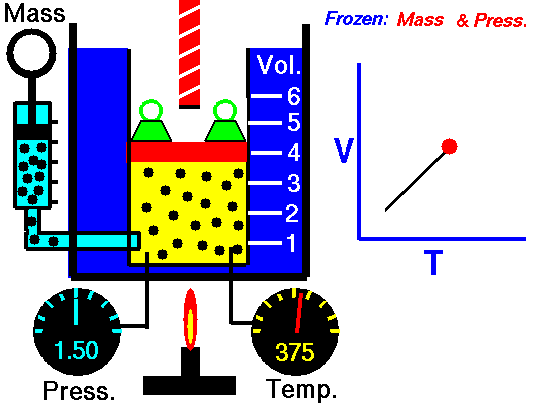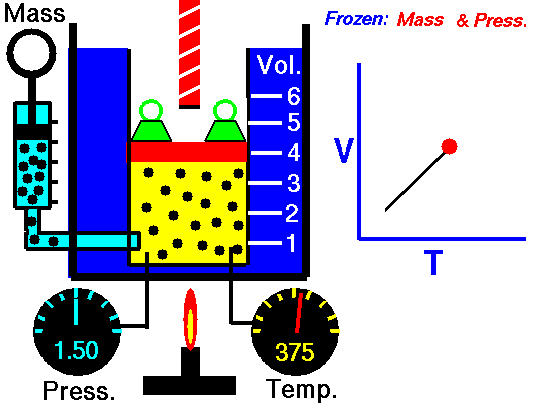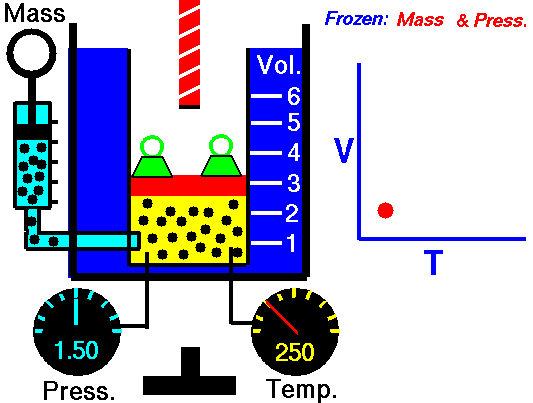
Charles ‘Gesetz
Charles ‘Gesetz ist eines der Gasgesetze. Ende des 18. Jahrhunderts untersuchte ein französischer Erfinder und Wissenschaftler, Jacques Alexandre César Charles, die Beziehung zwischen dem Volumen und der Temperatur eines Gases bei konstantem Druck . Die Ergebnisse bestimmter Experimente mit Gasen bei relativ niedrigem Druck veranlassten Jacques Alexandre César Charles, ein bekanntes Gesetz zu formulieren. Es sagt, dass:
Bei einer festen Gasmasse bei konstantem Druck ist das Volumen direkt proportional zur Kelvin-Temperatur.
Das heißt, wenn Sie beispielsweise die Temperatur verdoppeln, verdoppeln Sie die Lautstärke. Wenn Sie die Temperatur halbieren, halbieren Sie die Lautstärke.
Sie können dies mathematisch ausdrücken als:
V = konstant. T.
Ja, es scheint identisch zu sein mit dem isobaren Prozess des idealen Gases. Diese Ergebnisse stimmen voll und ganz mit dem idealen Gasgesetz überein , das bestimmt, dass die Konstante gleich nR / p ist . Wenn Sie die pV = nRT-Gleichung neu ordnen, indem Sie beide Seiten durch p teilen, erhalten Sie:
V = nR / p. T.
wobei nR / p konstant ist und:
- p ist der absolute Druck des Gases
- n ist die Substanzmenge
- T ist die absolute Temperatur
- V ist die Lautstärke
- R ist die ideale oder universelle Gaskonstante, die dem Produkt der Boltzmann-Konstante und der Avogadro-Konstante entspricht.
In dieser Gleichung ist das Symbol R eine Konstante, die als universelle Gaskonstante bezeichnet wird und für alle Gase den gleichen Wert hat, nämlich R = 8,31 J / mol K.
Bei einer festen Gasmasse bei konstantem Druck ist das Volumen direkt proportional zur Kelvin-Temperatur. Quelle: grc.nasa.gov Die NASA-Urheberrechtsrichtlinie besagt, dass „NASA-Material nicht urheberrechtlich geschützt ist, sofern nicht anders angegeben“
Guy-Lussacs Gesetz
Das Guy-Lussac-Gesetz oder das Druckgesetz ist eines der Gasgesetze. Im späten 18. und frühen 19. Jahrhundert wurde es vom französischen Chemiker Joseph Louis Gay-Lussac entdeckt . Er untersuchte die Beziehung zwischen dem Druck und der Temperatur eines Gases bei konstantem Volumen . Die Ergebnisse bestimmter Experimente mit Gasen bei relativ niedrigem Druck veranlassten Joseph Louis Gay-Lussac, ein bekanntes „ Druckgesetz “ zu formulieren . Es sagt, dass:
Bei einer festen Gasmasse bei konstantem Volumen ist der Druck direkt proportional zur Kelvin-Temperatur.
Das heißt, wenn Sie beispielsweise die Temperatur verdoppeln, verdoppeln Sie den Druck. Wenn Sie die Temperatur halbieren, halbieren Sie den Druck.
Sie können dies mathematisch ausdrücken als:
p = konstant. T.
Ja, es scheint identisch zu sein mit dem isochoren Prozess des idealen Gases. Diese Ergebnisse stimmen voll und ganz mit dem idealen Gasgesetz überein, das bestimmt, dass die Konstante gleich nR / V ist. Wenn Sie die pV = nRT-Gleichung neu ordnen, indem Sie beide Seiten durch V teilen, erhalten Sie:
p = nR / V. T.
wobei nR / V konstant ist und:
- p ist der absolute Druck des Gases
- n ist die Substanzmenge
- T ist die absolute Temperatur
- V ist die Lautstärke
- R ist die ideale oder universelle Gaskonstante, die dem Produkt der Boltzmann-Konstante und der Avogadro-Konstante entspricht.
In dieser Gleichung ist das Symbol R eine Konstante, die als universelle Gaskonstante bezeichnet wird und für alle Gase den gleichen Wert hat, nämlich R = 8,31 J / mol K.
Bei einer festen Gasmasse bei konstantem Volumen ist der Druck direkt proportional zur Kelvin-Temperatur. Quelle: grc.nasa.gov Die NASA-Urheberrechtsrichtlinie besagt, dass „NASA-Material nicht urheberrechtlich geschützt ist, sofern nicht anders angegeben“
Avogadros Gesetz
Das Avogadro-Gesetz ist eines der Gasgesetze. Zu Beginn des 19. Jahrhunderts untersuchte ein italienischer Wissenschaftler, Lorenzo Romano Amedeo Carlo Avogadro, die Beziehung zwischen dem Volumen und der Menge der vorhandenen Gassubstanz. Die Ergebnisse bestimmter Experimente mit Gasen veranlassten ihn, ein bekanntes Avogadro-Gesetz zu formulieren . Es heißt, dass unter den gleichen Temperatur- und Druckbedingungen gleiche Volumina verschiedener Gase eine gleiche Anzahl von Molekülen enthalten, oder:
Für eine feste Masse eines idealen Gases bei konstantem Druck und konstanter Temperatur sind Volumen und Menge des Gases direkt proportional.
Sie können dies mathematisch ausdrücken als:
V ∝ n
oder
V = konstant. n
wobei nR / V konstant ist und:
- n ist die in Mol gemessene Substanzmenge
- V ist das Volumen des Gases
Die Konstante ist gleich RT / p, wobei p der absolute Druck des Gases ist, T die absolute Temperatur ist und R die ideale oder universelle Gaskonstante ist, die gleich dem Produkt aus der Boltzmann-Konstante und der Avogadro-Konstante ist.
Avogadro Nummer
Als Hommage an Avogadro wurde auch die Anzahl der Partikel (Atome, Moleküle, Ionen oder andere Partikel) in 1 Mol einer Substanz, 6,022 × 10 23 , nach Avogadro als Avogadro-Konstante oder Avogadro-Zahl benannt . Die Avogadro – Konstante ist eines der sieben SI – Basiseinheiten und dargestellt durch N A .
Das Avogadro-Gesetz kann verwendet werden, um denselben Stoff unter zwei verschiedenen Bedingungen zu vergleichen:
V 1 / n 1 = V 2 / n 2
Molvolumen der Gase
Eines der praktischsten Ergebnisse dieses Gesetzes ist das Molvolumen eines Gases , V m , das ungefähr:
V m = 22,4 dm 3 / mol
Es bedeutet, bei Standardtemperatur (273,15 K, 0 ° C) und Standard – Atmosphärendruck (101,325 kPa) beträgt das molare Volumen das gleiche für alle idealen Gase ist. Beachten Sie, dass dies unter der idealen Gasannahme erfolgt. Dieser Wert ist stark vom Druck und der Temperatur abhängig. Beispielsweise:
- für 273,15 K (0 ° C) und 100,00 kPa beträgt das Molvolumen eines idealen Gases 22,71 dm 3 mol –1 .
- für 298,15 K (25 ° C) und 100,00 kPa beträgt das Molvolumen eines idealen Gases 24,79 dm 3 mol –1 .
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.