Lois sur le gaz
En général, les lois des gaz sont des premières équations d’état , qui corrèlent les densités de gaz et de liquides aux températures et aux pressions. Les lois sur le gaz ont été complètement développées à la fin du XVIIIe siècle. Ces lois ou déclarations ont précédé la loi du gaz parfait , car individuellement ces lois sont considérées comme des cas particuliers de l’équation du gaz parfait, avec une ou plusieurs des variables maintenues constantes. Puisqu’ils ont été presque complètement remplacés par l’équation du gaz parfait, il n’est pas habituel que les élèves apprennent ces lois en détail. L’ équation du gaz parfait a été énoncée pour la première fois par Émile Clapeyron en 1834 comme une combinaison de ces lois:
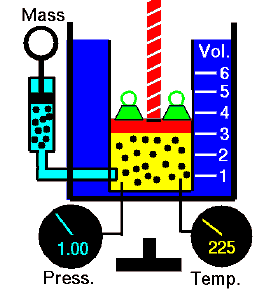
Loi de Boyle-Mariotte
La loi de Boyle-Mariotte est l’une des lois sur le gaz. À la fin du XVIIe siècle, Robert William Boyle et Edme Mariotte ont étudié indépendamment la relation entre le volume et la pression d’un gaz à température constante . Les résultats de certaines expériences avec des gaz à relativement basse pression ont conduit Robert Boyle à formuler une loi bien connue. Il déclare que:
Pour une masse fixe de gaz à température constante, le volume est inversement proportionnel à la pression.
Cela signifie que, par exemple, si vous augmentez le volume 10 fois, la pression diminuera 10 fois. Si vous divisez par deux le volume, vous doublerez la pression.
Vous pouvez exprimer cela mathématiquement comme:
pV = constant
ou
p 1 V 1 = p 2 V 2
Oui, il semble être identique au processus isotherme du gaz parfait. En fait, pendant leurs expériences, la température reste constante comme l’avait supposé Mariotte. Ces résultats sont parfaitement cohérents avec la loi du gaz parfait , qui détermine que la constante est égale à nRT .
pV = nRT
où:
- p est la pression absolue du gaz
- n est la quantité de substance
- T est la température absolue
- V est le volume
- R est la constante de gaz parfaite ou universelle, égale au produit de la constante de Boltzmann et de la constante d’Avogadro,
Dans cette équation, le symbole R est une constante appelée constante de gaz universelle qui a la même valeur pour tous les gaz, à savoir R = 8,31 J / mol K.
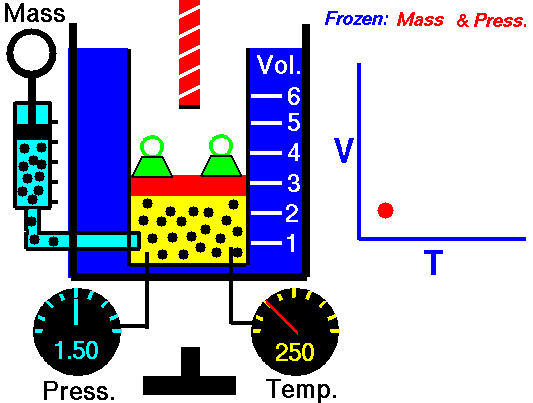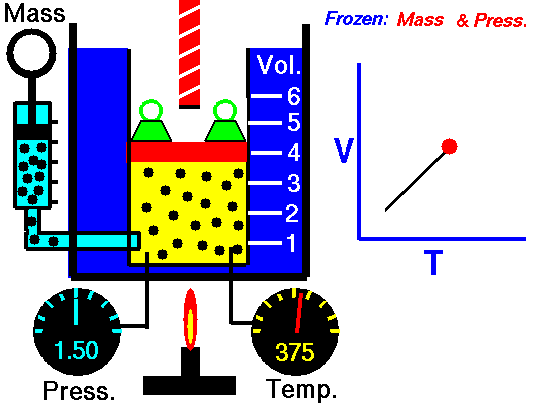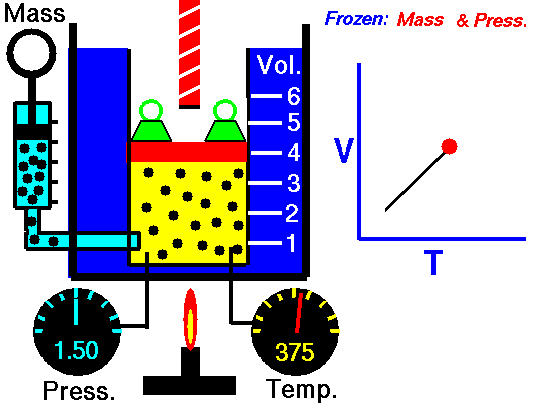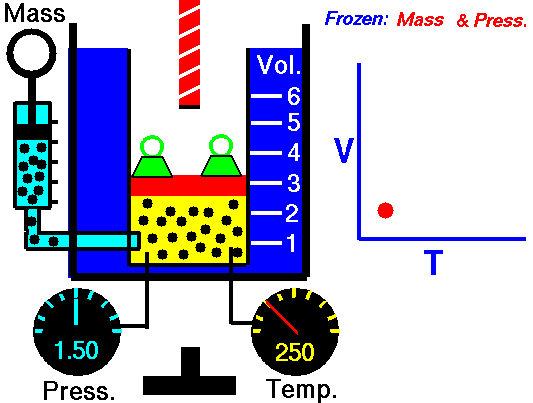
La loi de Charles
La loi de Charles est l’une des lois sur le gaz. À la fin du XVIIIe siècle, un inventeur et scientifique français Jacques Alexandre César Charles étudie la relation entre le volume et la température d’un gaz à pression constante . Les résultats de certaines expériences avec des gaz à relativement basse pression ont conduit Jacques Alexandre César Charles à formuler une loi bien connue. Il déclare que:
Pour une masse fixe de gaz à pression constante, le volume est directement proportionnel à la température Kelvin.
Cela signifie que, par exemple, si vous doublez la température, vous doublerez le volume. Si vous divisez par deux la température, vous réduisez de moitié le volume.
Vous pouvez exprimer cela mathématiquement comme:
V = constant. T
Oui, il semble être identique au processus isobare du gaz parfait. Ces résultats sont parfaitement cohérents avec la loi du gaz parfait , qui détermine que la constante est égale à nR / p . Si vous réorganisez l’équation pV = nRT en divisant les deux côtés par p, vous obtiendrez:
V = nR / p. T
où nR / p est constant et:
- p est la pression absolue du gaz
- n est la quantité de substance
- T est la température absolue
- V est le volume
- R est la constante de gaz parfaite ou universelle, égale au produit de la constante de Boltzmann et de la constante d’Avogadro,
Dans cette équation, le symbole R est une constante appelée constante de gaz universelle qui a la même valeur pour tous les gaz, à savoir R = 8,31 J / mol K.
Loi de Guy-Lussac
La loi de Guy-Lussac ou la loi de la pression est l’une des lois du gaz. À la fin du XVIIIe et au début du XIXe siècle, il a été découvert par le chimiste français Joseph Louis Gay-Lussac . Il a étudié la relation entre la pression et la température d’un gaz à volume constant . Les résultats de certaines expériences avec des gaz à relativement basse pression ont conduit Joseph Louis Gay-Lussac à formuler une « loi de pression » bien connue . Il déclare que:
Pour une masse fixe de gaz à volume constant, la pression est directement proportionnelle à la température Kelvin.
Cela signifie que, par exemple, si vous doublez la température, vous doublerez la pression. Si vous divisez par deux la température, vous réduisez de moitié la pression.
Vous pouvez exprimer cela mathématiquement comme:
p = constant. T
Oui, il semble être identique au processus isochore du gaz parfait. Ces résultats sont parfaitement cohérents avec la loi du gaz parfait, qui détermine que la constante est égale à nR / V. Si vous réorganisez l’équation pV = nRT en divisant les deux côtés par V, vous obtiendrez:
p = nR / V. T
où nR / V est constant et:
- p est la pression absolue du gaz
- n est la quantité de substance
- T est la température absolue
- V est le volume
- R est la constante de gaz parfaite ou universelle, égale au produit de la constante de Boltzmann et de la constante d’Avogadro,
Dans cette équation, le symbole R est une constante appelée constante de gaz universelle qui a la même valeur pour tous les gaz, à savoir R = 8,31 J / mol K.
Loi d’Avogadro
La loi d’Avogadro est l’une des lois sur le gaz. Au début du XIXe siècle, un scientifique italien Lorenzo Romano Amedeo Carlo Avogadro a étudié la relation entre le volume et la quantité de substance gazeuse présente. Les résultats de certaines expériences avec les gaz l’ont amené à formuler une loi d’Avogadro bien connue . Elle précise que, dans les mêmes conditions de température et de pression, des volumes égaux de gaz différents contiennent un nombre égal de molécules, soit:
Pour une masse fixe d’un gaz parfait à pression et température constantes, le volume et la quantité de gaz sont directement proportionnels.
Vous pouvez exprimer cela mathématiquement comme:
V ∝ n
ou
V = constant. n
où nR / V est constant et:
- n est la quantité de substance mesurée en moles
- V est le volume du gaz
la constante est égale à RT / p, où p est la pression absolue du gaz, T est la température absolue et R est la constante de gaz parfaite ou universelle, égale au produit de la constante de Boltzmann et de la constante d’Avogadro.
Numéro d’Avogadro
En hommage à Avogadro , le nombre de particules (atomes, molécules, ions ou autres particules) dans 1 mole d’une substance, 6,022 × 10 23 , a également été nommé d’après Avogadro comme constante d’ Avogadro ou nombre d’Avogadro . La constante d’ Avogadro est l’ un des sept unités de base SI et représenté par N A .
La loi d’Avogadro peut être utilisée pour comparer la même substance sous deux ensembles de conditions différents:
V 1 / n 1 = V 2 / n 2
Volume molaire des gaz
L’un des résultats les plus pratiques de cette loi est le volume molaire d’un gaz , V m , qui est d’environ:
V m = 22,4 dm 3 / mol
Cela signifie qu’à température standard (273,15 K, 0 ° C) et pression atmosphérique standard (101,325 kPa), le volume molaire est le même pour tous les gaz idéaux. Notez que c’est sous l’hypothèse de gaz parfait. Cette valeur dépend fortement de la pression et de la température. Par exemple:
- pour 273,15 K (0 ° C) et 100,00 kPa, le volume molaire d’un gaz parfait est de 22,71 dm 3 .mol -1 .
- pour 298,15 K (25 ° C) et 100,00 kPa, le volume molaire d’un gaz parfait est de 24,79 dm 3 .mol -1 .
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci