Leis do gás
Em geral, as leis dos gases são as primeiras equações de estado , que correlacionam densidades de gases e líquidos a temperaturas e pressões. As leis de gás foram completamente desenvolvidas no final do século XVIII. Essas leis ou declarações precederam a lei dos gases ideais , uma vez que, individualmente, essas leis são consideradas casos especiais da equação do gás ideal, com uma ou mais variáveis mantidas constantes. Como eles foram quase completamente substituídos pela equação de gás ideal, não é comum que os alunos aprendam essas leis em detalhes. A equação do gás ideal foi declarada pela primeira vez por Émile Clapeyron em 1834 como uma combinação dessas leis:
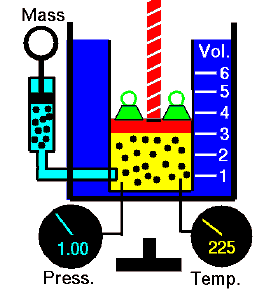
Lei de Boyle-Mariotte
A lei de Boyle-Mariotte é uma das leis de gás. No final do século XVII, Robert William Boyle e Edme Mariotte estudaram independentemente a relação entre o volume e a pressão de um gás a temperatura constante . Os resultados de certas experiências com gases sob pressão relativamente baixa levaram Robert Boyle a formular uma lei bem conhecida. Afirma que:
Para uma massa fixa de gás a temperatura constante, o volume é inversamente proporcional à pressão.
Isso significa que, por exemplo, se você aumentar o volume 10 vezes, a pressão diminuirá 10 vezes. Se você reduzir pela metade o volume, dobrará a pressão.
Você pode expressar isso matematicamente como:
pV = constante
ou
p 1 V 1 = p 2 V 2
Sim, parece ser idêntico ao processo isotérmico do gás ideal. De fato, durante seus experimentos, a temperatura permanece constante, como foi assumido por Mariotte. Esses resultados são totalmente consistentes com a lei ideal dos gases , que determina que a constante é igual a nRT .
pV = nRT
Onde:
- p é a pressão absoluta do gás
- n é a quantidade de substância
- T é a temperatura absoluta
- V é o volume
- R é a constante de gás ideal, ou universal, igual ao produto da constante de Boltzmann e da constante de Avogadro,
Nesta equação, o símbolo R é uma constante chamada constante universal de gás que tem o mesmo valor para todos os gases – ou seja, R = 8,31 J / mol K.
Lei de Charles
A lei de Charles é uma das leis de gás. No final do século XVIII, o inventor e cientista francês Jacques Alexandre César Charles estudou a relação entre o volume e a temperatura de um gás sob pressão constante . Os resultados de certas experiências com gases sob pressão relativamente baixa levaram Jacques Alexandre César Charles a formular uma lei bem conhecida. Afirma que:
Para uma massa fixa de gás a pressão constante, o volume é diretamente proporcional à temperatura Kelvin.
Isso significa que, por exemplo, se você dobrar a temperatura, dobrará o volume. Se você reduzir pela metade a temperatura, reduzirá pela metade o volume.
Você pode expressar isso matematicamente como:
V = constante. T
Sim, parece ser idêntico ao processo isobárico do gás ideal. Esses resultados são totalmente consistentes com a lei ideal dos gases , que determina que a constante é igual a nR / p . Se você reorganizar a equação pV = nRT dividindo os dois lados por p, obterá:
V = nR / p. T
onde nR / p é constante e:
- p é a pressão absoluta do gás
- n é a quantidade de substância
- T é a temperatura absoluta
- V é o volume
- R é a constante de gás ideal, ou universal, igual ao produto da constante de Boltzmann e da constante de Avogadro,
Nesta equação, o símbolo R é uma constante chamada constante universal de gás que tem o mesmo valor para todos os gases – ou seja, R = 8,31 J / mol K.
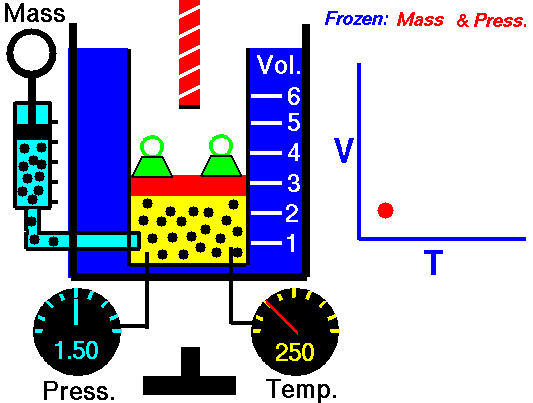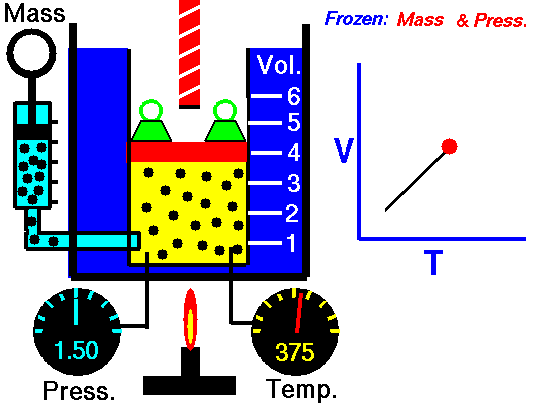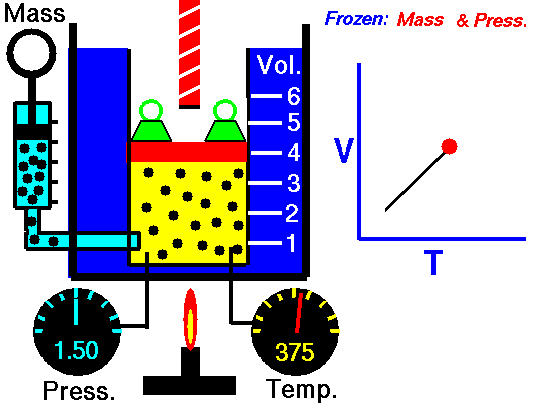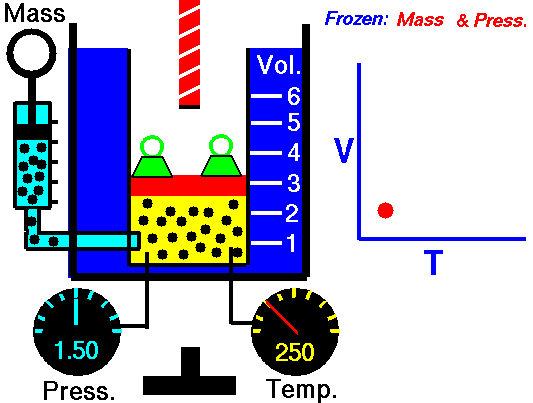
Lei de Guy-Lussac
A lei de Guy-Lussac ou a lei de pressão é uma das leis de gás. No final do século 18 e início do século 19, foi descoberto pelo químico francês Joseph Louis Gay-Lussac . Ele estudou a relação entre a pressão e a temperatura de um gás em volume constante . Os resultados de certas experiências com gases sob pressão relativamente baixa levaram Joseph Louis Gay-Lussac a formular uma conhecida ” lei da pressão “. Afirma que:
Para uma massa fixa de gás em volume constante, a pressão é diretamente proporcional à temperatura Kelvin.
Isso significa que, por exemplo, se você dobrar a temperatura, dobrará a pressão. Se você reduzir pela metade a temperatura, reduzirá a pressão pela metade.
Você pode expressar isso matematicamente como:
p = constante. T
Sim, parece ser idêntico ao processo isocórico do gás ideal. Esses resultados são totalmente consistentes com a lei ideal dos gases, que determina que a constante é igual a nR / V. Se você reorganizar a equação pV = nRT dividindo os dois lados por V, obterá:
p = nR / V. T
onde nR / V é constante e:
- p é a pressão absoluta do gás
- n é a quantidade de substância
- T é a temperatura absoluta
- V é o volume
- R é a constante de gás ideal, ou universal, igual ao produto da constante de Boltzmann e da constante de Avogadro,
Nesta equação, o símbolo R é uma constante chamada constante universal de gás que tem o mesmo valor para todos os gases – ou seja, R = 8,31 J / mol K.
Lei de Avogadro
A lei de Avogadro é uma das leis de gás. No início do século XIX, um cientista italiano Lorenzo Romano Amedeo Carlo Avogadro estudou a relação entre o volume e a quantidade de substância presente no gás. Os resultados de certas experiências com gases o levaram a formular uma conhecida Lei de Avogadro . Afirma que, nas mesmas condições de temperatura e pressão, volumes iguais de gases diferentes contêm um número igual de moléculas, ou:
Para uma massa fixa de um gás ideal a pressão e temperatura constantes, o volume e a quantidade do gás são diretamente proporcionais.
Você pode expressar isso matematicamente como:
V ∝ n
ou
V = constante. n
onde nR / V é constante e:
- n é a quantidade de substância medida em moles
- V é o volume do gás
a constante é igual a RT / p, onde p é a pressão absoluta do gás, T é a temperatura absoluta e R é a constante de gás ideal, ou universal, igual ao produto da constante de Boltzmann e da constante de Avogadro.
Número de Avogadro
Em homenagem a Avogadro , também o número de partículas (átomos, moléculas, íons ou outras partículas) em 1 mole de uma substância, 6.022 × 10 23 , recebeu o nome de Avogadro como constante de Avogadro ou número de Avogadro . A constante de Avogadro é uma das unidades de base SI sete e representado por N A .
A Lei de Avogadro pode ser usada para comparar a mesma substância sob dois conjuntos diferentes de condições:
V 1 / n 1 = V 2 / n 2
Volume molar de gases
Um dos resultados mais práticos desta lei é o volume molar de um gás , V m , que é sobre:
V m = 22,4 dm 3 / mol
Isso significa que, à temperatura padrão (273,15 K, 0 ° C) e pressão atmosférica padrão (101,325 kPa), o volume molar é o mesmo para todos os gases ideais. Observe que está sob a hipótese ideal de gás. Este valor é fortemente dependente da pressão e da temperatura. Por exemplo:
- para 273,15 K (0 ° C) e 100,00 kPa, o volume molar de um gás ideal é 22,71 dm 3 .mol −1 .
- para 298,15 K (25 ° C) e 100,00 kPa, o volume molar de um gás ideal é 24,79 dm 3 .mol −1 .
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.