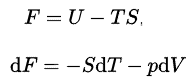Helmholtz Freie Energie
In der Thermodynamik ist die Helmholtz-Freie Energie ein thermodynamisches Potential, das als die innere Energie des Systems minus dem Produkt aus Temperatur und Entropie des Systems definiert wird. Es misst die „nützliche“ Arbeit, die mit einem geschlossenen thermodynamischen System bei konstantem Volumen und Druck erzielt werden kann. Die Helmhotz-freie Energie ist definiert als:
Die innere Energie U hat eine genaue physikalische Bedeutung, sie ist die Summe aller kinetischen und potentiellen Energien aller Teilchen im System. Der zweite Term ist der Betrag der spontanen Energieübertragung TS, wobei S die endgültige Entropie des Systems ist. Bei einem Prozess mit konstanter Temperatur liefert die Helmholtz-Freie Energie die gesamte reversible Arbeit. Wenn ein Physiker “freie Energie” ohne Angabe von Helmholtz oder Gibbs sagt, bedeutet dies normalerweise Helmholtz-freie Energie. Wenn ein Chemiker “freie Energie” sagt, bedeutet dies fast immer Gibbs-freie Energie .