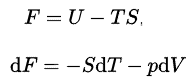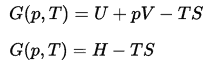Thermodynamische Potenziale
Thermodynamische Potentiale sind skalare Größen, mit denen Zustandsfunktionen dargestellt werden. Thermodynamische Potentiale beschreiben zusammen mit den entsprechenden Zustandsgleichungen das Gleichgewichtsverhalten eines Systems in Abhängigkeit von sogenannten “natürlichen Variablen”.
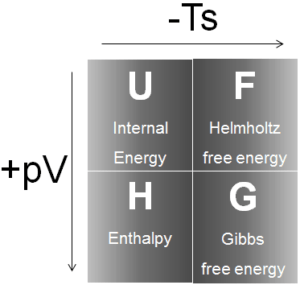
Vier gebräuchliche thermodynamische Potenziale sind:
Innere Energie
In der Thermodynamik wird innere Energie (auch als Wärmeenergie bezeichnet ) als die Energie definiert, die mit mikroskopischen Energieformen verbunden ist . Es handelt sich um eine umfangreiche Menge , die von der Größe des Systems oder der Menge der darin enthaltenen Substanz abhängt. Die SI-Einheit der inneren Energie ist das Joule (J) . Es ist die im System enthaltene Energie, ohne die kinetische Bewegungsenergie des Gesamtsystems und die potentielle Energie des Systems. Mikroskopische Energieformen sind solche, die auf Rotation , Vibration, Translation und Wechselwirkungen zurückzuführen sindunter den Molekülen einer Substanz. Keine dieser Energieformen kann direkt gemessen oder ausgewertet werden, es wurden jedoch Techniken entwickelt, um die Veränderung der Gesamtsumme all dieser mikroskopischen Energieformen zu bewerten.
Außerdem kann Energie in den chemischen Bindungen zwischen den Atomen gespeichert werden, aus denen die Moleküle bestehen. Diese Energiespeicherung auf atomarer Ebene schließt Energie ein, die mit Elektronenorbitalzuständen, Kernspin und Bindungskräften im Kern verbunden ist.
Enthalpie
In der Thermodynamik ist die Enthalpie ein Maß für die Energie in einem thermodynamischen System. Dies ist die thermodynamische Größe, die dem gesamten Wärmeinhalt eines Systems entspricht. Die Enthalpie ist definiert als die Summe der inneren Energie E plus dem Produkt aus Druck p und Volumen V. In vielen thermodynamischen Analysen erscheint die Summe der inneren Energie U und des Produkts aus Druck p und Volumen V als zweckmäßig um der Kombination einen Namen, eine Enthalpie und ein eindeutiges Symbol zu geben, H.
H = U + pV
Die Enthalpie ist der bevorzugte Ausdruck von Systemenergieänderungen bei vielen chemischen, biologischen und physikalischen Messungen bei konstantem Druck . Es ist so nützlich, dass es in den Dampftabellen zusammen mit dem spezifischen Volumen und der spezifischen inneren Energie tabellarisch aufgeführt ist . Dies liegt an der Tatsache, dass es die Beschreibung der Energieübertragung vereinfacht . Bei konstantem Druck entspricht die Enthalpieänderung der Energie, die durch Erhitzen (Q = H 2 – H 1 ) oder andere Arbeiten als Expansionsarbeiten aus der Umgebung übertragen wird . Bei einem Prozess mit variablem Druck ist der Unterschied in der Enthalpie nicht ganz so offensichtlich.
Helmholtz Freie Energie
In der Thermodynamik ist die freie Helmholtz-Energie ein thermodynamisches Potential, das als die innere Energie des Systems abzüglich des Produkts aus Temperatur und Entropie des Systems definiert ist. Es misst die „nützliche“ Arbeit, die mit einem geschlossenen thermodynamischen System bei konstantem Volumen und Druck erzielt werden kann. Die freie Energie von Helmhotz ist definiert als:
Die innere Energie U hat eine genaue physikalische Bedeutung, sie ist die Summe aller kinetischen und potentiellen Energien aller Teilchen im System. Der zweite Term ist der Betrag der spontanen Energieübertragung TS, wobei S die endgültige Entropie des Systems ist. Für einen Prozess mit konstanter Temperatur liefert die freie Helmholtz-Energie die gesamte reversible Arbeit. Wenn ein Physiker „freie Energie“ sagt, ohne Helmholtz oder Gibbs anzuzeigen, bedeutet dies normalerweise Helmholtz-freie Energie. Wenn ein Chemiker hingegen „freie Energie“ sagt, bedeutet dies fast immer Gibbs-freie Energie .
Gibbs Freie Energie
In der Thermodynamik ist die freie Gibbs-Energie ein thermodynamisches Potential, das als Enthalpie des Systems abzüglich des Produkts aus Temperatur und Entropie des Systems definiert ist. Da die Enthalpie definiert ist als die Summe der inneren Energie E plus dem Produkt aus Druck p und Volumen V, ist die freie Gibbs-Energie definiert als:
Die Änderung der freien Gibbs-Energie ΔG in der Chemie ist ein sehr nützlicher Parameter. Es kann als der maximale Arbeitsaufwand angesehen werden, der durch eine Reaktion erzielt werden kann.
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.