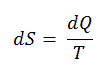Cambio de entropía
El SI unidad para la entropía es J / K . Según Clausius, la entropía se definió mediante el cambio en la entropía S de un sistema. El cambio en la entropía S, cuando se le agrega una cantidad de calor Q mediante un proceso reversible a temperatura constante, viene dado por:
Aquí Q es la energía transferida como calor hacia o desde el sistema durante el proceso, y T es la temperatura del sistema en grados Kelvin durante el proceso. Si suponemos un proceso isotérmico reversible , el cambio de entropía total viene dado por:
∆S = S 2 – S 1 = Q / T
En esta ecuación, el cociente Q / T está relacionado con el aumento del desorden. Mayor temperatura significa mayor aleatoriedad de movimiento. A temperaturas más bajas, la adición de calor Q provoca un aumento fraccional sustancial en el movimiento molecular y la aleatoriedad. Por otro lado, si la sustancia ya está caliente, la misma cantidad de calor Q agrega relativamente poco al mayor movimiento molecular.
Ejemplo: cambio de entropía en el hielo derretido
Calcule el cambio en la entropía de 1 kg de hielo a 0 ° C, cuando se derrite reversiblemente en agua a 0 ° C.
Dado que es un proceso isotérmico, podemos usar:
∆S = S 2 – S 1 = Q / T
por lo tanto, el cambio de entropía será:
∆S = 334 [kJ] / 273.15 [K] = 1.22 [kJ / K]
donde se requieren 334 kilojulios de calor para derretir 1 kg de hielo (calor de fusión latente = 334 kJ / kg) y este calor se transfiere al sistema a 0 ° C (273,15 K).
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.