pΔV trabajo
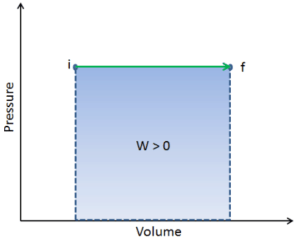
El trabajo de presión-volumen (o trabajo pΔV ) ocurre cuando cambia el volumen V de un sistema. El trabajo pΔV es igual al área bajo la curva de proceso trazada en el diagrama de presión-volumen. También se conoce como el trabajo de límites . El trabajo de límite ocurre porque la masa de la sustancia contenida dentro del límite del sistema causa una fuerza, la presión multiplicada por el área de superficie, para actuar sobre la superficie del límite y hacer que se mueva. El trabajo de límite (o pΔV Work ) ocurre cuando el volumen V de un sistema cambia . Se utiliza para calcular el trabajo de desplazamiento del pistón en un sistema cerrado.. Esto es lo que sucede cuando el vapor o el gas contenido en un dispositivo de pistón-cilindro se expande contra el pistón y lo obliga a moverse.
Ejemplo:
Considere un pistón sin fricción que se utiliza para proporcionar una presión constante de 500 kPa en un vapor cilindro que contiene ( vapor sobrecalentado ) de un volumen de 2 m 3 a 500 K .
Calcule la temperatura final, si se agregan 3000 kJ de calor .
Solución:
Usando tablas de vapor , sabemos que la entalpía específica de dicho vapor (500 kPa; 500 K) es de aproximadamente 2912 kJ / kg . Dado que en esta condición el vapor tiene una densidad de 2.2 kg / m 3 , entonces sabemos que hay alrededor de 4.4 kg de vapor en el pistón a una entalpía de 2912 kJ / kg x 4.4 kg = 12812 kJ .
Cuando usamos simplemente Q = H 2 – H 1 , la entalpía de vapor resultante será:
H 2 = H 1 + Q = 15812 kJ
De las mesas de vapor , dicho vapor sobrecalentado (15812 / 4.4 = 3593 kJ / kg) tendrá una temperatura de 828 K (555 ° C) . Como en esta entalpía el vapor tiene una densidad de 1,31 kg / m 3 , es obvio que se ha expandido aproximadamente 2,2 / 1,31 = 1,67 (+ 67%). Por lo tanto, el volumen resultante es 2 m 3 x 1.67 = 3.34 m 3 y ∆V = 3.34 m 3 – 2 m 3 = 1.34 m 3 .
La parte p∆V de la entalpía, es decir, el trabajo realizado es:
W = p∆V = 500 000 Pa x 1.34 m 3 = 670 kJ
———–
Durante el cambio de volumen , la presión y la temperatura también pueden cambiar. Para calcular tales procesos, necesitaríamos saber cómo la presión varía con el volumen para el proceso real por el cual el sistema cambia del estado i al estado f . La primera ley de la termodinámica y el trabajo se pueden expresar como:
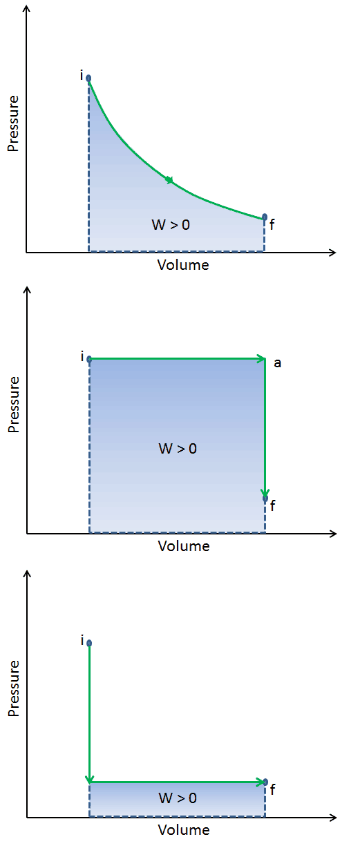
Cuando un sistema termodinámico cambia de un estado inicial a un estado final , pasa a través de una serie de estados intermedios . Llamamos a esta serie de estados un camino . Siempre hay infinitas posibilidades diferentes para estos estados intermedios. Cuando todos son estados de equilibrio, la ruta se puede trazar en un diagrama pV . Una de las conclusiones más importantes es que:
El trabajo realizado por el sistema depende no solo de los estados inicial y final, sino también de los estados intermedios, es decir, de la ruta.
Q y W dependen de la ruta, mientras que ΔE int es independiente de la ruta. Como se puede ver en la imagen (diagrama pV), el trabajo es una variable dependiente de la ruta. El área azul representa el trabajo pΔV realizado por un sistema a medida que pasa de un estado inicial i a un estado final f. El trabajo W es positivo porque aumenta el volumen del sistema. El segundo proceso muestra que el trabajo es mayor y que depende de la ruta del proceso.
Además, podemos llevar el sistema a través de una serie de estados que forman un circuito cerrado , como i ⇒ f ⇒ i . En este caso, el estado final es el mismo que el estado inicial , pero el trabajo total realizado por el sistema no es cero . Un valor positivo para el trabajo indica que el trabajo lo realiza el sistema en su entorno. Un valor negativo indica que el trabajo se realiza en el sistema por su entorno.
Primera ley en términos de entalpía dH = dQ + Vdp
La entalpía se define para ser la suma de la energía interna E más el producto de la presión p y el volumen V . En muchos análisis termodinámicos aparece la suma de la energía interna U y el producto de la presión py el volumen V, por lo tanto, es conveniente dar a la combinación un nombre, entalpía y un símbolo distintivo, H.
H = U + pV
Ver también: entalpía
La primera ley de la termodinámica en términos de entalpía nos muestra por qué los ingenieros usan la entalpía en ciclos termodinámicos (por ejemplo, el ciclo de Brayton o el ciclo de Rankine ).
La forma clásica de la ley es la siguiente ecuación:
dU = dQ – dW
En esta ecuación, dW es igual a dW = pdV y se conoce como el trabajo límite .
Obtenemos la ley en términos de entalpía:
dH = dQ + Vdp
o
dH = TdS + Vdp
En esta ecuación, el término Vdp es un proceso de flujo de trabajo. Este trabajo, Vdp , se utiliza para sistemas de flujo abierto como una turbina o una bomba en la que hay un “dp” , es decir, un cambio de presión. No hay cambios en el volumen de control . Como puede verse, esta forma de ley simplifica la descripción de la transferencia de energía . A presión constante , el cambio de entalpía es igual a la energía transferida del ambiente a través del calentamiento:
Proceso isobárico (Vdp = 0):
dH = dQ → Q = H 2 – H 1
En una entropía constante , es decir, en un proceso isentrópico, el cambio de entalpía es igual al trabajo del proceso de flujo realizado en o por el sistema:
Proceso isentrópico (dQ = 0):
dH = Vdp → W = H 2 – H 1
Es obvio, será muy útil en el análisis de los dos ciclos termodinámicos utilizados en la ingeniería de energía, es decir, en el ciclo de Brayton y el ciclo de Rankine.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.
