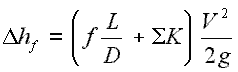Processo de estrangulamento – processo isentálpico
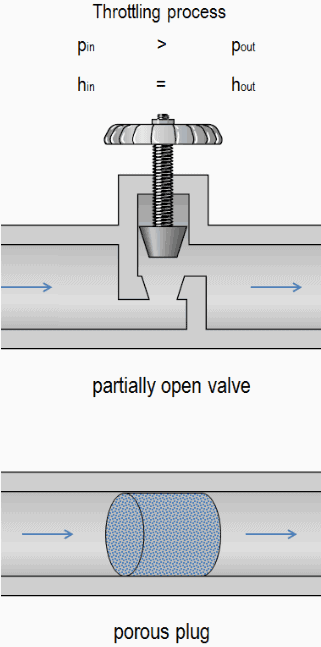
Um processo de estrangulamento é um processo termodinâmico , no qual a entalpia do gás ou do meio permanece constante (h = const) . De fato, o processo de estrangulamento é um dos processos isentálicos . Durante o processo de estrangulamento, nenhum trabalho é realizado pelo sistema (dW = 0) e, geralmente, não há transferência de calor ( adiabática ) do ou para o sistema (dQ = 0). Por outro lado, o processo de estrangulamento não pode ser isentrópico, é um processo fundamentalmente irreversível . Características do processo de estrangulamento:
- Transferência sem trabalho
- Sem transferência de calor
- Processo irreversível
- Processo isentálpico
Um estrangulamento do fluxo causa uma redução significativa da pressão , porque um dispositivo de estrangulamento causa uma perda de pressão local . Uma limitação pode ser alcançada simplesmente introduzindo uma restrição em uma linha através da qual um gás ou líquido flui. Essa restrição é comumente feita por meio de uma válvula parcialmente aberta ou um bujão poroso. Tais perdas de pressão são geralmente denominadas perdas menores , embora geralmente representem uma parte importante da perda de carga . As perdas menores são aproximadamente proporcional ao quadrado da taxa de fluxo e, portanto, eles podem ser facilmente integrados na equação de Darcy-Weisbach através de coeficiente de resistência K .
Uma válvula parcialmente aberta ou um bujão poroso pode ser usado para reduzir a pressão em um sistema.
Regulagem do vapor úmido
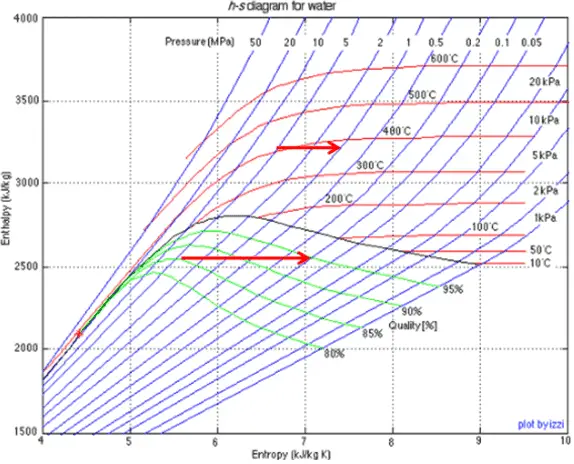
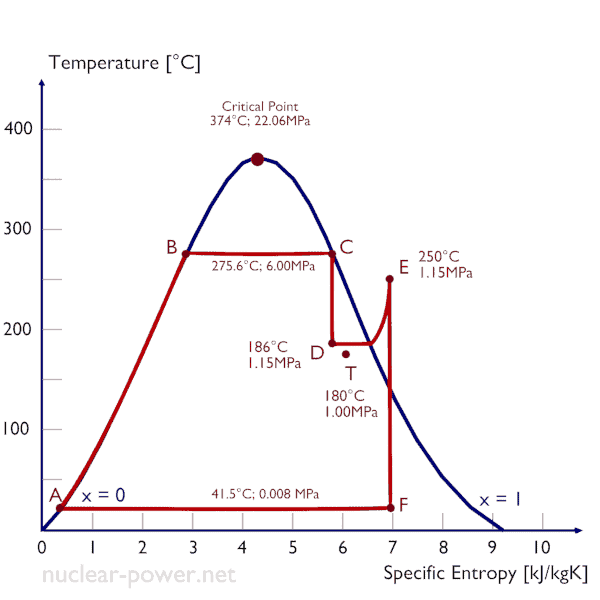
O vapor úmido é caracterizado pela qualidade do vapor , que varia de zero a unidade – intervalo aberto (0,1). A limitação do vapor úmido também está associada à conservação da entalpia . A entalpia é conservada porque nenhum trabalho é realizado pelo sistema (dW = 0) e, geralmente, não há transferência de calor (adiabática) do ou para o sistema (dQ = 0). Mas, neste caso, uma redução na pressão causa um aumento na qualidade do vapor . À medida que a pressão cai, parte do líquido no vapor úmido vaporiza e aumenta a qualidade do vapor (ou seja, a fração de secura). Esse processo ocorre porque a temperatura de saturaçãoé menor na pressão mais baixa. A temperatura mais baixa, a pressão mais baixa e o vapor de maior qualidade contêm a mesma entalpia que o vapor original.
Exemplo: Regulagem de vapor úmido
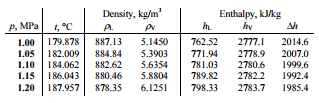
Um estágio de alta pressão da turbina a vapor opera em estado estacionário com condições de entrada de 6 MPa, t = 275,6 ° C, x = 1 (ponto C). O vapor sai deste estágio da turbina a uma pressão de 1,15 MPa, 186 ° C ex = 0,87 (ponto D). Determine a qualidade do vapor quando regulado entre 1,15 MPa e 1,0 MPa. Suponha que o processo seja adiabático e que nenhum trabalho seja realizado pelo sistema.
Veja também: Tabelas Steam
Solução:
A entalpia para o estado D deve ser calculada usando a qualidade do vapor:
h D, úmido = h D, vapor x + (1 – x) h D, líquido = 2782. 0,87 + (1 – 0,87). 790 = 2420 + 103 = 2523 kJ / kg
Como é um processo isentálico, conhecemos a entalpia do ponto T. Nas tabelas de vapor, temos que encontrar a qualidade do vapor usando a mesma equação e resolvendo a equação para a qualidade do vapor, x:
h T, úmido = h T, vapor x + (1 – x) h T, líquido
x = ( h T, úmido – h T, líquido ) / ( h T, vapor – h T, líquido ) = (2523 – 762) / (2777 – 762) = 0,874 = 87,4%
Neste caso do processo de estrangulamento (1,15 MPa a 1MPa), a qualidade do vapor aumenta de 87% para 87,4% e a temperatura diminui de 186 ° C para 179,9 ° C.
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.