Processos termodinâmicos
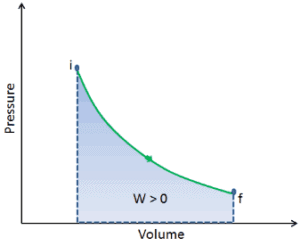 Um processo termodinâmico é definido como uma mudança de um macroestado de equilíbrio para outro macroestado. Os estados inicial e final são os elementos definidores do processo. Durante um tal processo, um sistema começa a partir de um estado inicial de i , descrito por uma pressão p i , um volume V i e uma temperatura T i , passa através de vários estados quase-estático para um estado final f , descrito por uma pressão p f , uma volume V f e temperatura T f . Nesse processoa energia pode ser transferida do formulário ou para o sistema e também o trabalho pode ser feito pelo sistema. Um exemplo de um processo termodinâmico é aumentar a pressão de um gás enquanto mantém uma temperatura constante. Na seção a seguir, há exemplos de processos termodinâmicos que são da maior importância na engenharia de motores térmicos .
Um processo termodinâmico é definido como uma mudança de um macroestado de equilíbrio para outro macroestado. Os estados inicial e final são os elementos definidores do processo. Durante um tal processo, um sistema começa a partir de um estado inicial de i , descrito por uma pressão p i , um volume V i e uma temperatura T i , passa através de vários estados quase-estático para um estado final f , descrito por uma pressão p f , uma volume V f e temperatura T f . Nesse processoa energia pode ser transferida do formulário ou para o sistema e também o trabalho pode ser feito pelo sistema. Um exemplo de um processo termodinâmico é aumentar a pressão de um gás enquanto mantém uma temperatura constante. Na seção a seguir, há exemplos de processos termodinâmicos que são da maior importância na engenharia de motores térmicos .
Tipos de processos termodinâmicos
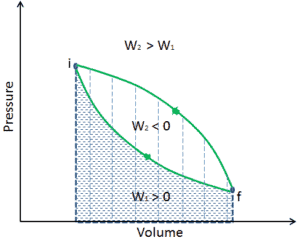
Processo reversível
Na termodinâmica, um processo reversível é definido como um processo que pode ser revertido pela indução de alterações infinitesimais em alguma propriedade do sistema e, ao fazê-lo, não deixa mudanças no sistema ou nos arredores. Durante o processo reversível, a entropia do sistema não aumenta e o sistema está em equilíbrio termodinâmico com o ambiente.
Processo irreversível
Na termodinâmica, um processo irreversível é definido como um processo que não pode ser revertido, processo, que não pode retornar o sistema e o ambiente a suas condições originais.
Durante o processo irreversível, a entropia do sistema aumenta .
Processo cíclico
Um processo que eventualmente retorna um sistema ao seu estado inicial é chamado de processo cíclico . Na conclusão de um ciclo, todas as propriedades têm o mesmo valor que tinham no início. Para esse processo, o estado final é o mesmo que o estado inicial e, portanto, a mudança total de energia interna deve ser zero.
Deve-se notar que, de acordo com a segunda lei da termodinâmica , nem todo o calor fornecido a um ciclo pode ser transformado em uma quantidade igual de trabalho; alguma rejeição de calor deve ocorrer. A eficiência térmica , η th , de qualquer motor de calor como a razão entre o trabalho que faz, W , para o calor de entrada a uma temperatura elevada, Q H . η th = W / Q H .
Vide também: Processo reversível
Veja também: Processo irreversível
Veja também: Processo cíclico
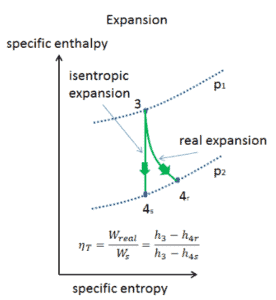
Processo isentrópico
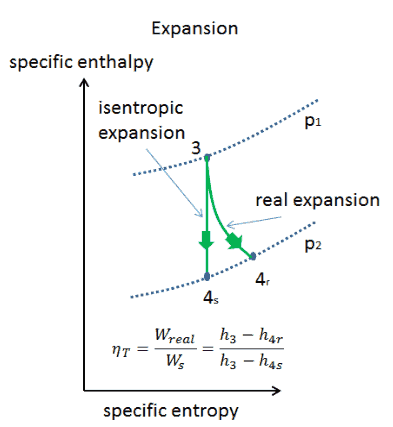
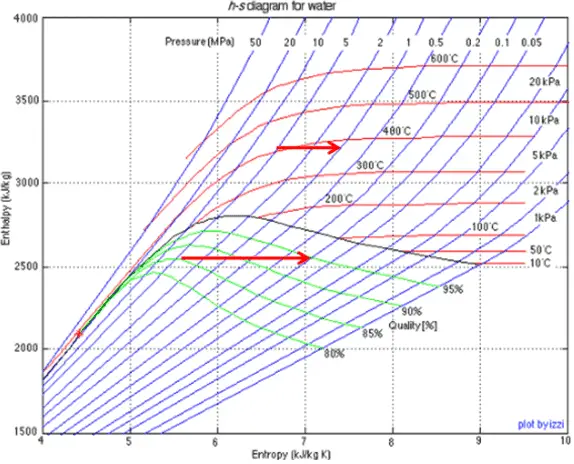
Um processo isentrópico é um processo termodinâmico , no qual a entropia do fluido ou gás permanece constante. Isso significa que o processo isentrópico é um caso especial de um processo adiabático no qual não há transferência de calor ou matéria. É um processo adiabático reversível . Um processo isentrópico também pode ser chamado de processo de entropia constante. Na engenharia, esse processo idealizado é muito útil para comparação com processos reais.
Veja também: Processo isentrópico
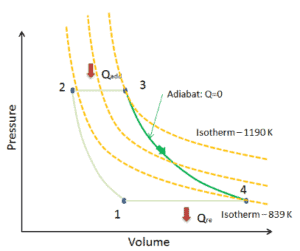
Diagrama PV de uma expansão isentrópica de hélio (3 → 4) em uma turbina a gás
Processo Adiabático
Um processo adiabático é um processo termodinâmico , no qual não há transferência de calor para dentro ou para fora do sistema (Q = 0). O sistema pode ser considerado perfeitamente isolado . Em um processo adiabático, a energia é transferida apenas como trabalho. A suposição de que não há transferência de calor é muito importante, pois podemos usar a aproximação adiabática apenas em processos muito rápidos . Nesses processos rápidos, não há tempo suficiente para que a transferência de energia como calor ocorra de ou para o sistema.
Em dispositivos reais (como turbinas, bombas e compressores) ocorrem perdas e perdas de calor no processo de combustão, mas essas perdas são geralmente baixas em comparação com o fluxo geral de energia e podemos aproximar alguns processos termodinâmicos pelo processo adiabático.
Veja também: Processo adiabático
Expansão isentrópica vs. adiabática.
Processo isotérmico
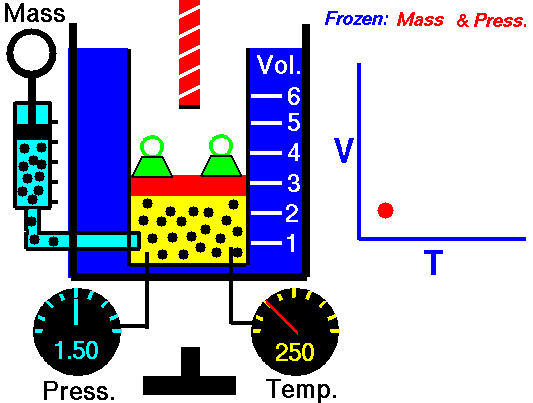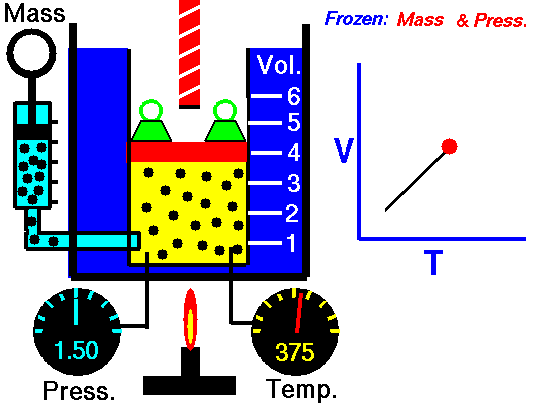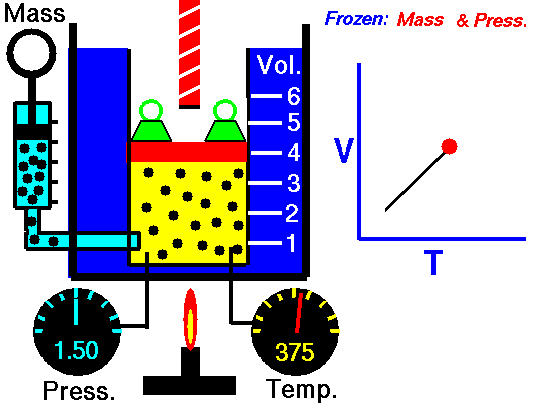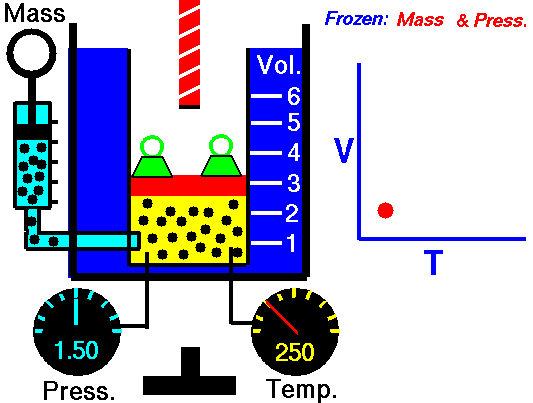
Um processo isotérmico é um processo termodinâmico , no qual a temperatura do sistema permanece constante (T = const). A transferência de calor para dentro ou para fora do sistema geralmente deve ocorrer a uma taxa tão lenta, a fim de se ajustar continuamente à temperatura do reservatório através da troca de calor. Em cada um desses estados, o equilíbrio térmico é mantido.
Para um gás ideal e um processo politrópico, o caso n = 1 corresponde a um processo isotérmico (temperatura constante). Ao contrário do processo adiabático , no qual n = κ e um sistema não trocam calor com o ambiente (Q = 0; ∆T ≠ 0 ) , em um processo isotérmico não há alteração na energia interna (devido a ∆T = 0 ) e, portanto, ΔU = 0 (para gases ideais) e Q ≠ 0. Um processo adiabático não é necessariamente um processo isotérmico, nem um processo isotérmico é necessariamente adiabático.
Veja também: Processo isotérmico
Lei de Boyle-Mariotte. Para uma massa fixa de gás a temperatura constante, o volume é inversamente proporcional à pressão. Fonte: grc.nasa.gov A política de direitos autorais da NASA afirma que “o material da NASA não é protegido por direitos autorais, a menos que seja observado”
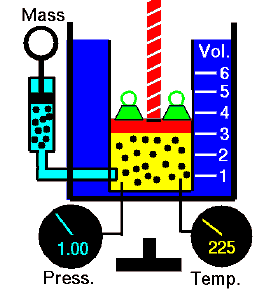
Processo isobárico
Um processo isobárico é um processo termodinâmico , no qual a pressão do sistema permanece constante (p = const). A transferência de calor para dentro ou para fora do sistema funciona, mas também altera a energia interna do sistema.
Como existem mudanças na energia interna (dU) e no volume do sistema (∆V), os engenheiros costumam usar a entalpia do sistema, que é definida como:
H = U + pV
Em muitas análises termodinâmicas, é conveniente usar a entalpia em vez da energia interna. Especialmente no caso da primeira lei da termodinâmica .
Na engenharia, os dois ciclos termodinâmicos muito importantes (ciclo de Brayton e Rankine ) são baseados em dois processos isobáricos ; portanto, o estudo desse processo é crucial para as usinas de energia.
Veja também: Processo isobárico
Para uma massa fixa de gás a pressão constante, o volume é diretamente proporcional à temperatura Kelvin. Fonte: grc.nasa.gov A política de direitos autorais da NASA afirma que “o material da NASA não é protegido por direitos autorais, a menos que seja observado
Processo Isocórico
Um processo isocórico é um processo termodinâmico, no qual o volume do sistema fechado permanece constante (V = const). Ele descreve o comportamento do gás dentro do recipiente, que não pode ser deformado. Como o volume permanece constante, a transferência de calor para dentro ou para fora do sistema não funciona em p∆V , mas apenas altera a energia interna (a temperatura) do sistema.
Na engenharia de motores de combustão interna , os processos isocóricos são muito importantes para seus ciclos termodinâmicos (ciclo Otto e Diesel), portanto, o estudo desse processo é crucial para a engenharia automotiva.
Veja também: Processo isocórico
Para uma massa fixa de gás em volume constante, a pressão é diretamente proporcional à temperatura Kelvin
Processo Politrópico
Um processo politrópico é qualquer processo termodinâmico que pode ser expresso pela seguinte equação:
pV n = constante
O processo politrópico pode descrever a expansão e compressão de gás que incluem transferência de calor . O expoente n é conhecido como índice politrópico e pode assumir qualquer valor de 0 a ∞, dependendo do processo específico.
Veja também: Processo Polytropic
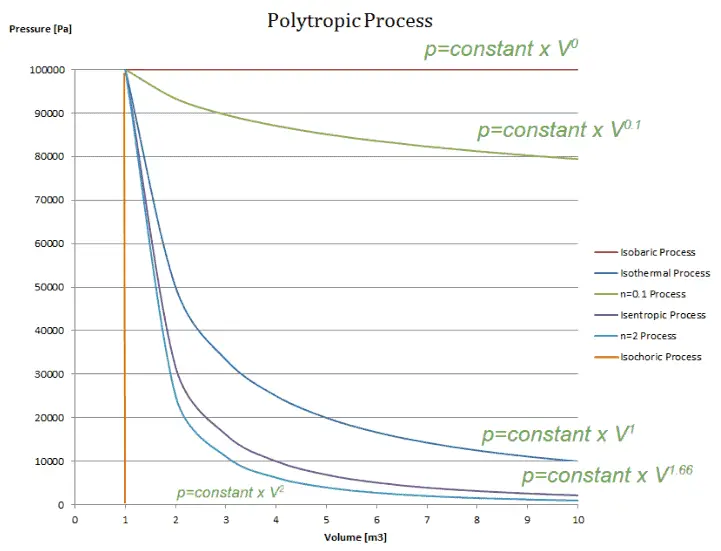 Processos politrópicos com vários índices politrópicos
Processos politrópicos com vários índices politrópicos
Processo de estrangulamento – processo isentálpico
Um processo de estrangulamento é um processo termodinâmico , no qual a entalpia do gás ou do meio permanece constante (h = const) . De fato, o processo de estrangulamento é um dos processos isentálicos . Durante o processo de estrangulamento, nenhum trabalho é realizado pelo sistema (dW = 0) e, geralmente, não há transferência de calor ( adiabática ) do ou para o sistema (dQ = 0). Por outro lado, o processo de estrangulamento não pode ser isentrópico, é um processo fundamentalmente irreversível . Características do processo de estrangulamento:
- Transferência sem trabalho
- Sem transferência de calor
- Processo irreversível
- Processo isentálpico
A limitação do vapor úmido também está associada à conservação da entalpia . Mas, neste caso, uma redução na pressão causa um aumento na qualidade do vapor .
Vide também: Processo de limitação
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.