Saturação
 Na termodinâmica, o termo saturação define uma condição na qual uma mistura de vapor e líquido pode existir juntos a uma dada temperatura e pressão. A temperatura na qual a vaporização (ebulição) começa a ocorrer para uma dada pressão é chamada de temperatura de saturação ou ponto de ebulição . A pressão na qual a vaporização (fervendo) começa a ocorrer para uma dada temperatura é chamada pressão de saturação.
Na termodinâmica, o termo saturação define uma condição na qual uma mistura de vapor e líquido pode existir juntos a uma dada temperatura e pressão. A temperatura na qual a vaporização (ebulição) começa a ocorrer para uma dada pressão é chamada de temperatura de saturação ou ponto de ebulição . A pressão na qual a vaporização (fervendo) começa a ocorrer para uma dada temperatura é chamada pressão de saturação.
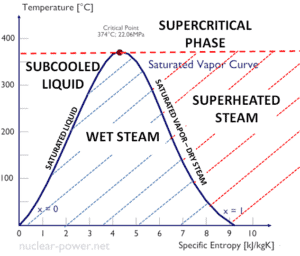
Quando a qualidade do vapor é igual a 0, é chamado de estado líquido saturado (monofásico). Por outro lado, quando a qualidade do vapor é igual a 1, é chamado estado de vapor saturado ou vapor seco (monofásico). Entre esses dois estados, falamos sobre mistura líquido-vapor ou vapor úmido (mistura bifásica). A pressão constante, uma adição de energia não altera a temperatura da mistura, mas a qualidade do vapor e o volume específico mudam.
Por exemplo: No pressurizador de reatores de água pressurizada, a temperatura de saturação é de cerca de 350 ° C, mas isso corresponde à pressão de 16,4 MPa, que deve ser mantida no circuito primário. Para uma substância pura, existe uma relação definida entre a pressão de saturação e a temperatura de saturação. Quanto maior a pressão, maior a temperatura de saturação. A representação gráfica dessa relação entre temperatura e pressão em condições saturadas é chamada curva de pressão de vapor e pode ser vista no diagrama de fases da água . Este diagrama é mostrado na figura.
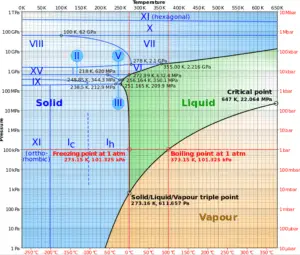
Fonte: wikipedia.org CC BY-SA
Como pode ser visto no diagrama de fases da água, nas regiões bifásicas (por exemplo, na fronteira das fases vapor / líquido), a especificação da temperatura sozinha definirá a pressão e a pressão especificada definirá a temperatura.
- A curva de vapor de saturação é a curva que separa o estado de duas fases e o estado de vapor superaquecido no diagrama Ts.
- A curva de líquido saturado é a curva que separa o estado líquido sub – resfriado e o estado bifásico no diagrama Ts.
Entalpia específica do vapor úmido
A entalpia específica da água líquida saturada (x = 0) e do vapor seco (x = 1) pode ser selecionada nas tabelas de vapor. No caso de vapor úmido , a entalpia real pode ser calculada com a qualidade do vapor, xe as entalpias específicas de água líquida saturada e vapor seco:
h molhado = h s x + (1 – x) h l
Onde
h úmido = entalpia do vapor úmido (J / kg)
h s = entalpia do vapor “seco” (J / kg)
h l = entalpia de água líquida saturada (J / kg)
Como pode ser visto, o vapor úmido sempre terá entalpia menor do que o vapor seco.
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.