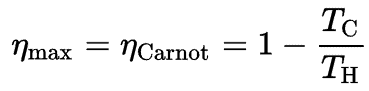Dritter Hauptsatz der Thermodynamik – 3. Hauptsatz
Die Entropie eines Systems nähert sich einem konstanten Wert, wenn sich die Temperatur dem absoluten Nullpunkt nähert.
Basierend auf empirischen Beweisen besagt dieses Gesetz, dass die Entropie einer reinen kristallinen Substanz beim absoluten Nullpunkt der Temperatur 0 K Null ist und dass es mit keinem noch so idealisierten Verfahren möglich ist, die Temperatur eines Systems zu senken in einer endlichen Anzahl von Schritten auf den absoluten Nullpunkt. Dies ermöglicht es uns, einen Nullpunkt für die Wärmeenergie eines Körpers zu definieren.
______
Der dritte Hauptsatz der Thermodynamik wurde vom deutschen Chemiker Walther Nernst in den Jahren 1906-12 entwickelt. Für diese Forschung gewann Walther Nernst 1920 den Nobelpreis für Chemie. Daher wird der dritte Hauptsatz der Thermodynamik oft als Nernst-Theorem oder Nernst-Postulat bezeichnet . Wie zu sehen ist, besagt der dritte Hauptsatz der Thermodynamik, dass sich die Entropie eines Systems im thermodynamischen Gleichgewicht Null nähert, wenn sich die Temperatur Null nähert. Oder umgekehrt nähert sich die absolute Temperatur einer reinen kristallinen Substanz im thermodynamischen Gleichgewicht Null an, wenn sich die Entropie Null nähert.
Der Satz von Nernst Heat (eine Konsequenz des dritten Gesetzes) lautet:
Es ist für jeden noch so idealisierten Prozess unmöglich, die Entropie eines Systems in einer endlichen Anzahl von Operationen auf ihren absoluten Nullwert zu reduzieren.
Mathematisch:
Der Nernst-Wärmesatz wurde später von einem deutschen Physiker Max Planck verwendet, um den dritten Hauptsatz der Thermodynamik in Bezug auf Entropie und absoluten Nullpunkt zu definieren.
Einige Materialien (z. B. amorphe Feststoffe) haben beim absoluten Nullpunkt keine genau definierte Ordnung. In diesen Materialien (z. B. Glas) bleibt auch eine endliche Entropie auf dem absoluten Nullpunkt, da die mikroskopische Struktur des Systems (Atom für Atom) auf unterschiedliche Weise angeordnet werden kann (W ≠ 1). Diese konstante Entropie ist als Restentropie bekannt, die die Differenz zwischen einem Nichtgleichgewichtszustand und einem Kristallzustand einer Substanz nahe dem absoluten Nullpunkt darstellt.
Beachten Sie, dass die genaue Definition der Entropie lautet:
Entropie = (Boltzmannsche Konstante k) x Logarithmus der Anzahl möglicher Zustände
S = k B logW
Diese Gleichung, die die mikroskopischen Details oder Mikrozustände des Systems (über W ) mit seinem makroskopischen Zustand (über die Entropie S ) in Beziehung setzt , ist die Schlüsselidee der statistischen Mechanik.
Absoluter Nullpunkt
Absoluter Nullpunkt ist die kälteste theoretische Temperatur, bei der die thermische Bewegung von Atomen und Molekülen ihr Minimum erreicht. Dies ist ein Zustand, in dem die Enthalpie und Entropie eines abgekühlten idealen Gases ihren Minimalwert von 0 erreicht.
Mathematisch:
lim S T → 0 = 0
wo
S = Entropie (J / K)
T = absolute Temperatur (K)
Klassischerweise wäre dies ein Zustand der Bewegungslosigkeit , aber die Quantenunsicherheit schreibt vor, dass die Teilchen immer noch eine endliche Nullpunktsenergie besitzen . Der absolute Nullpunkt wird auf der Kelvin-Skala als 0 K, auf der Celsius-Skala als –273,15 ° C und auf der Fahrenheit-Skala als –459,67 ° F bezeichnet .
Beziehung zu Wärmekraftmaschinen
Nach dem Carnot-Prinzip, das Grenzen für den maximalen Wirkungsgrad einer Wärmekraftmaschine festlegt, ist der Carnot-Wirkungsgrad. Dieses Prinzip besagt auch, dass der Wirkungsgrad eines Carnot-Zyklus ausschließlich von der Differenz zwischen den Warm- und Kalttemperaturspeichern abhängt.
wo:
- ist der Wirkungsgrad des Carnot-Zyklus, dh das Verhältnis = W / Q H der vom Motor geleisteten Arbeit zur Wärmeenergie, die aus dem heißen Speicher in das System gelangt.
- T C ist die absolute Temperatur (Kelvin) des kalten Reservoirs,
- T H ist die absolute Temperatur (Kelvin) des heißen Reservoirs,
Das dritte Gesetz schreibt vor, dass T C niemals Null sein kann, daher sehen wir, dass eine 100% effiziente Wärmekraftmaschine nicht möglich ist.
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.