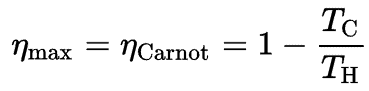Tercera Ley de Termodinámica – Tercera Ley
La entropía de un sistema se aproxima a un valor constante a medida que la temperatura se acerca al cero absoluto.
Basado en evidencia empírica, esta ley establece que la entropía de una sustancia cristalina pura es cero en el cero absoluto de temperatura , 0 K y que es imposible mediante cualquier proceso, sin importar cuán idealizado esté, reducir la temperatura de un sistema a cero absoluto en un número finito de pasos. Esto nos permite definir un punto cero para la energía térmica de un cuerpo.
______
La tercera ley de la termodinámica fue desarrollada por el químico alemán Walther Nernst durante los años 1906–12. Por esta investigación, Walther Nernst ganó el Premio Nobel de Química de 1920. Por lo tanto, la tercera ley de la termodinámica a menudo se denomina teorema de Nernst o postulado de Nernst . Como se puede ver, la tercera ley de la termodinámica establece que la entropía de un sistema en equilibrio termodinámico se aproxima a cero cuando la temperatura se acerca a cero. O, por el contrario, la temperatura absoluta de cualquier sustancia cristalina pura en equilibrio termodinámico se aproxima a cero cuando la entropía se acerca a cero.
El Teorema del calor de Nernst (una consecuencia de la Tercera Ley) es:
Es imposible para cualquier proceso, sin importar cuán idealizado esté, reducir la entropía de un sistema a su valor de cero absoluto en un número finito de operaciones.
Matemáticamente:
El teorema del calor de Nernst fue utilizado más tarde por un físico alemán Max Planck para definir la tercera ley de la termodinámica en términos de entropía y cero absoluto.
Algunos materiales (por ejemplo, cualquier sólido amorfo) no tienen un orden bien definido en cero absoluto. En estos materiales (p. Ej., Vidrio), la entropía finita también permanece en cero absoluto, porque la estructura microscópica del sistema (átomo por átomo) se puede organizar de diferentes maneras (W ≠ 1). Esta entropía constante se conoce como entropía residual, que es la diferencia entre un estado de no equilibrio y el estado cristalino de una sustancia cercana al cero absoluto.
Tenga en cuenta que la definición exacta de entropía es:
Entropía = (constante de Boltzmann k) x logaritmo del número de estados posibles
S = k B logW
Esta ecuación, que relaciona los detalles microscópicos, o microestados, del sistema (a través de W ) con su estado macroscópico (a través de la entropía S ), es la idea clave de la mecánica estadística.
Cero absoluto
El cero absoluto es la temperatura teórica más fría, a la cual el movimiento térmico de los átomos y las moléculas alcanza su mínimo. Este es un estado en el que la entalpía y la entropía de un gas ideal enfriado alcanza su valor mínimo, tomado como 0.
Matemáticamente:
lim S T → 0 = 0
dónde
S = entropía (J / K)
T = temperatura absoluta (K)
Clásicamente , este sería un estado de inmovilidad , pero la incertidumbre cuántica dicta que las partículas todavía poseen una energía finita de punto cero . El cero absoluto se denota como 0 K en la escala Kelvin, −273.15 ° C en la escala Celsius y −459.67 ° F en la escala Fahrenheit.
Relación con los motores de calor
De acuerdo con el principio de Carnot, eso especifica límites en la eficiencia máxima que cualquier motor térmico puede tener es la eficiencia de Carnot. Este principio también establece que la eficiencia de un ciclo de Carnot depende únicamente de la diferencia entre los depósitos de temperatura fría y caliente.
dónde:
- es la eficiencia del ciclo de Carnot, es decir, es la relación = W / Q H del trabajo realizado por el motor a la energía térmica que ingresa al sistema desde el depósito caliente.
- T C es la temperatura absoluta (Kelvins) del depósito frío,
- T H es la temperatura absoluta (Kelvins) del depósito caliente,
La tercera ley dicta que T C nunca puede ser cero, por lo tanto, vemos que un motor térmico 100% eficiente no es posible.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.