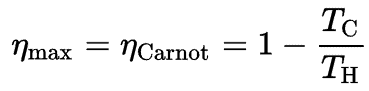Terceira Lei da Termodinâmica – Terceira Lei
A entropia de um sistema se aproxima de um valor constante à medida que a temperatura se aproxima do zero absoluto.
Com base em evidências empíricas, esta lei afirma que a entropia de uma substância cristalina pura é zero no zero absoluto da temperatura , 0 K e que é impossível por meio de qualquer processo, não importa o ideal, reduzir a temperatura de um sistema para zero absoluto em um número finito de etapas. Isso nos permite definir um ponto zero para a energia térmica de um corpo.
______
A terceira lei da termodinâmica foi desenvolvida pelo químico alemão Walther Nernst durante os anos de 1906–12. Para esta pesquisa, Walther Nernst ganhou o Prêmio Nobel de 1920 em química. Portanto, a terceira lei da termodinâmica é frequentemente referida como teorema de Nernst ou postulado de Nernst . Como pode ser visto, a terceira lei da termodinâmica afirma que a entropia de um sistema em equilíbrio termodinâmico se aproxima de zero quando a temperatura se aproxima de zero. Ou, inversamente, a temperatura absoluta de qualquer substância cristalina pura em equilíbrio termodinâmico se aproxima de zero quando a entropia se aproxima de zero.
O Teorema de Nernst Heat (uma conseqüência da Terceira Lei) é:
É impossível para qualquer processo, não importa quão idealizado, reduzir a entropia de um sistema ao seu valor zero absoluto em um número finito de operações.
Matematicamente:
O teorema do calor de Nernst foi mais tarde usado pelo físico alemão Max Planck para definir a terceira lei da termodinâmica em termos de entropia e zero absoluto.
Alguns materiais (por exemplo, qualquer sólido amorfo) não têm uma ordem bem definida no zero absoluto. Nesses materiais (por exemplo, vidro), alguma entropia finita permanece também no zero absoluto, porque a estrutura microscópica do sistema (átomo por átomo) pode ser organizada de maneiras diferentes (W ≠ 1). Essa entropia constante é conhecida como entropia residual, que é a diferença entre um estado de não equilíbrio e um estado cristalino de uma substância próxima ao zero absoluto.
Observe que a definição exata de entropia é:
Entropia = (constante k de Boltzmann) x logaritmo do número de estados possíveis
S = k B logW
Essa equação, que relaciona os detalhes microscópicos, ou microestados, do sistema (via W ) ao seu estado macroscópico (via entropia S ), é a idéia principal da mecânica estatística.
Zero absoluto
O zero absoluto é a temperatura teórica mais fria, na qual o movimento térmico de átomos e moléculas atinge seu mínimo. Este é um estado no qual a entalpia e a entropia de um gás ideal resfriado atingem seu valor mínimo, tomado como 0.
Matematicamente:
lim S T → 0 = 0
Onde
S = entropia (J / K)
T = temperatura absoluta (K)
Classicamente , este seria um estado de imobilidade , mas a incerteza quântica determina que as partículas ainda possuem uma energia finita de ponto zero . O zero absoluto é indicado como 0 K na escala Kelvin, -273,15 ° C na escala Celsius e -459,67 ° F na escala Fahrenheit.
Relação com Motores de Calor
De acordo com o princípio de Carnot, que especifica limites para a eficiência máxima que qualquer motor térmico pode ter é a eficiência de Carnot. Esse princípio também afirma que a eficiência de um ciclo de Carnot depende apenas da diferença entre os reservatórios de temperatura quente e fria.
Onde:
- é a eficiência do ciclo de Carnot, ie é a proporção = W / Q H do trabalho realizado pelo motor com a energia de calor que entra no sistema a partir do reservatório quente.
- T C é a temperatura absoluta (Kelvins) do reservatório frio,
- T H é a temperatura absoluta (Kelvin) do reservatório quente,
A terceira lei determina que o T C nunca pode ser zero; portanto, vemos que um mecanismo térmico 100% eficiente não é possível.
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.