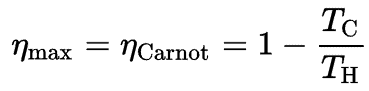Troisième loi de la thermodynamique – Troisième loi
L’entropie d’un système se rapproche d’une valeur constante lorsque la température approche le zéro absolu.
Sur la base de preuves empiriques, cette loi stipule que l’ entropie d’une substance cristalline pure est égale à zéro au zéro absolu de la température , 0 K et qu’il est impossible, par quelque procédé que ce soit, peu importe la méthode idéalisée, de réduire la température d’un système. à zéro absolu en un nombre fini d’étapes. Cela nous permet de définir un point zéro pour l’énergie thermique d’un corps.
______
La troisième loi de la thermodynamique a été développée par le chimiste allemand Walther Nernst au cours des années 1906-12. Pour cette recherche, Walther Nernst a remporté le prix Nobel de 1920 en chimie. Par conséquent, le troisième principe de la thermodynamique est souvent appelée théorème de Nernst ou postulat de Nernst . Comme on peut le constater, le troisième principe de la thermodynamique stipule que l’entropie d’un système en équilibre thermodynamique approche de zéro lorsque la température est proche de zéro. Ou inversement, la température absolue de toute substance cristalline pure en équilibre thermodynamique approche de zéro lorsque l’ entropie s’approche de zéro.
Le théorème de Nernst Heat (une conséquence de le troisième principe) est:
Il est impossible pour un processus quelconque, aussi idéalisé soit-il, de réduire l’entropie d’un système à sa valeur zéro absolu en un nombre fini d’opérations.
Mathématiquement:
Le théorème de la chaleur de Nernst a ensuite été utilisé par le physicien allemand Max Planck pour définir le troisième principe de la thermodynamique en termes d’entropie et de zéro absolu.
Certains matériaux (par exemple tout solide amorphe) n’ont pas d’ordre bien défini au zéro absolu. Dans ces matériaux (par exemple le verre), une entropie finie reste également à zéro absolu, car la structure microscopique du système (atome par atome) peut être agencée de différentes manières (W 1). Cette entropie constante est appelée entropie résiduelle, c’est-à-dire la différence entre un état de non-équilibre et l’état de cristal d’une substance proche du zéro absolu.
Notez que la définition exacte de l’entropie est:
Entropie = (constante de Boltzmann k) x logarithme du nombre d’états possibles
S = k B logW
Cette équation, qui relie les détails microscopiques, ou microstats, du système (via W ) à son état macroscopique (via l’ entropie S ), est l’idée clé de la mécanique statistique.
Zéro absolu
Le zéro absolu est la température théorique la plus froide, à laquelle le mouvement thermique des atomes et des molécules atteint son minimum. Il s’agit d’un état auquel l’enthalpie et l’entropie d’un gaz parfait refroidi atteint sa valeur minimale, prise à 0.
Mathématiquement:
lim S T → 0 = 0
où
S = entropie (J / K)
T = température absolue (K)
Classiquement , ce serait un état d’ immobilité , mais l’ incertitude quantique dicte que les particules possèdent toujours une énergie de point zéro finie . Le zéro absolu est noté 0 K sur l’échelle Kelvin, −273,15 ° C sur l’échelle Celsius et −459,67 ° F sur l’échelle Fahrenheit.
Relation avec les moteurs thermiques
Selon le principe de Carnot, qui spécifie des limites sur l’efficacité maximale que tout moteur thermique peut avoir est l’efficacité de Carnot. Ce principe stipule également que l’efficacité d’un cycle de Carnot dépend uniquement de la différence entre les réservoirs de température chaud et froid.
où:
- est l’efficacité du cycle de Carnot, c’est-à-dire le rapport = W / Q H du travail effectué par le moteur sur l’énergie thermique entrant dans le système depuis le réservoir chaud.
- T C est la température absolue (Kelvins) du réservoir froid,
- T H est la température absolue (Kelvins) du réservoir chaud,
La troisième loi stipule que T C ne peut jamais être nul, donc nous voyons qu’un moteur thermique 100% efficace n’est pas possible.
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci