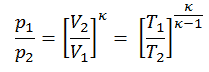Adiabatischer Prozess
Ein adiabatischer Prozess ist ein thermodynamischer Prozess , bei dem keine Wärmeübertragung in das oder aus dem System erfolgt (Q = 0). Das System kann als perfekt isoliert angesehen werden . In einem adiabatischen Prozess wird Energie nur als Arbeit übertragen. Die Annahme, dass keine Wärmeübertragung stattfindet, ist sehr wichtig, da wir die adiabatische Approximation nur in sehr schnellen Prozessen verwenden können . Bei diesen schnellen Prozessen bleibt nicht genügend Zeit, um Energie als Wärme in das oder aus dem System zu übertragen.
In realen Geräten (wie Turbinen, Pumpen und Kompressoren) treten Wärmeverluste und Verluste im Verbrennungsprozess auf. Diese Verluste sind jedoch im Vergleich zum Gesamtenergiefluss normalerweise gering, und wir können einige thermodynamische Prozesse durch den adiabatischen Prozess approximieren.
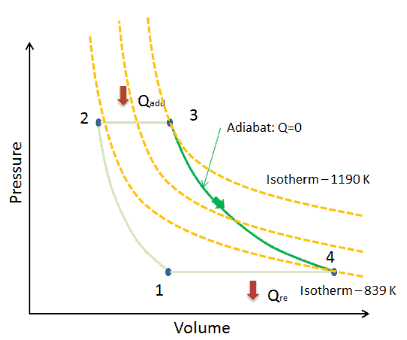
Adiabatische Kurve – Adiabat
Siehe auch: Was ist ein ideales Gas?
In einem idealen Gas haben Moleküle kein Volumen und interagieren nicht. Nach dem idealen Gasgesetz ändert sich der Druck linear mit der Temperatur und der Menge und umgekehrt mit dem Volumen .
pV = nRT
wo:
- p ist der absolute Druck des Gases
- n ist die Substanzmenge
- T ist die absolute Temperatur
- V ist die Lautstärke
- R ist die ideale oder universelle Gaskonstante, die dem Produkt der Boltzmann-Konstante und der Avogadro-Konstante entspricht.
In dieser Gleichung ist das Symbol R eine Konstante, die als universelle Gaskonstante bezeichnet wird und für alle Gase den gleichen Wert hat, nämlich R = 8,31 J / mol K.
Der adiabatische Prozess kann mit dem idealen Gasgesetz ausgedrückt werden als:
pV κ = konstant
oder
p 1 V 1 κ = p 2 V 2 κ
wobei κ = c p / c v das Verhältnis der spezifischen Wärme (oder Wärmekapazitäten ) für das Gas ist. Eine für konstanten Druck (c p ) und eine für konstantes Volumen (c v ) . Es ist zu beachten, dass dieses Verhältnis κ = c p / c v ein Faktor bei der Bestimmung der Schallgeschwindigkeit in einem Gas und anderen adiabatischen Prozessen ist.
Andere p, V, T-Beziehung
In einem pV-Diagramm erfolgt der Prozess entlang einer Linie ( Adiabat genannt ) mit der Gleichung p = Konstante / V κ . Für ein ideales Gas und einen polytropischen Prozess entspricht der Fall n = κ einem adiabatischen Prozess.
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.