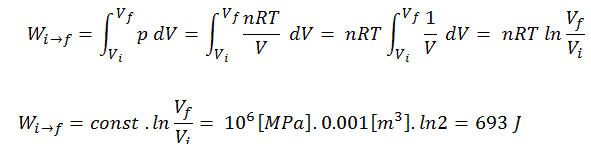Isothermer Prozess
Ein isothermer Prozess ist ein thermodynamischer Prozess , bei dem die Temperatur des Systems konstant bleibt (T = const). Die Wärmeübertragung in oder aus dem System muss typischerweise mit einer so langsamen Geschwindigkeit erfolgen, um sich durch Wärmeaustausch kontinuierlich an die Temperatur des Speichers anzupassen. In jedem dieser Zustände bleibt das thermische Gleichgewicht erhalten.
Für ein ideales Gasund einen polytropischen Prozess entspricht der Fall n = 1 einem isothermen Prozess (konstante Temperatur). Im Gegensatz zum adiabatischen Prozess , bei dem n = κ und ein System keine Wärme mit seiner Umgebung austauscht (Q = 0; ∆T ≠ 0 ) , ändert sich bei einem isothermen Prozess die innere Energie nicht (aufgrund von ∆T = 0) ) und daher ΔU = 0 (für ideale Gase) und Q ≠ 0. Ein adiabatischer Prozess ist nicht notwendigerweise ein isothermer Prozess, noch ist ein isothermer Prozess notwendigerweise adiabatisch.
In der Technik sind Phasenänderungen wie Verdampfung oder Schmelzen isotherme Prozesse, wenn sie wie gewöhnlich bei konstantem Druck und konstanter Temperatur auftreten.
Isothermer Prozess und das erste Gesetz
Die klassische Form des ersten Hauptsatzes der Thermodynamik ist die folgende Gleichung:
dU = dQ – dW
In dieser Gleichung ist dW gleich dW = pdV und ist bekannt als die Grenz Arbeit .
Bei isothermen Prozessen und dem idealen Gas wird die gesamte dem System zugeführte Wärme für folgende Arbeiten verwendet:
Isothermer Prozess (dU = 0):
dU = 0 = Q – W → W = Q (für ideales Gas)
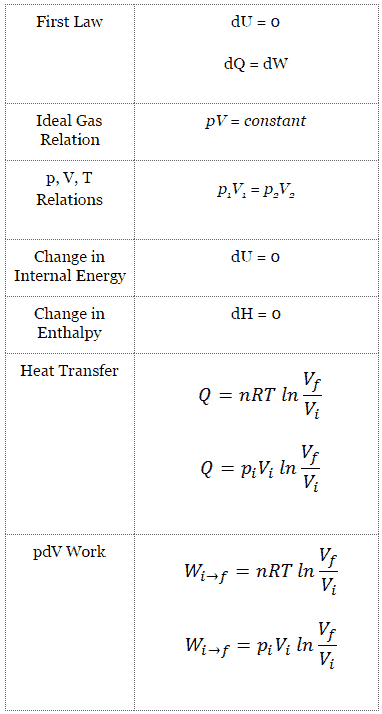

Isotherme Expansion – Isotherme Kompression
Siehe auch: Was ist ein ideales Gas?
 In einem idealen Gas haben Moleküle kein Volumen und interagieren nicht. Nach dem idealen Gasgesetz ändert sich der Druck linear mit Temperatur und Menge und umgekehrt mit dem Volumen .
In einem idealen Gas haben Moleküle kein Volumen und interagieren nicht. Nach dem idealen Gasgesetz ändert sich der Druck linear mit Temperatur und Menge und umgekehrt mit dem Volumen .
pV = nRT
wo:
- p ist der absolute Druck des Gases
- n ist die Substanzmenge
- T ist die absolute Temperatur
- V ist die Lautstärke
- R ist die ideale oder universelle Gaskonstante, die dem Produkt der Boltzmann-Konstante und der Avogadro-Konstante entspricht.
In dieser Gleichung ist das Symbol R eine Konstante, die als universelle Gaskonstante bezeichnet wird und für alle Gase den gleichen Wert hat, nämlich R = 8,31 J / mol K.
Der isotherme Prozess kann mit dem idealen Gasgesetz ausgedrückt werden als:
pV = konstant
oder
p 1 V 1 = p 2 V 2
Auf einem pV – Diagramm, tritt der Prozess entlang einer Linie (eine Isotherme genannt), die die Gleichung hat p = constant / V .
Boyle-Mariotte-Gesetz
Das Boyle-Mariotte-Gesetz ist eines der Gasgesetze . Ende des 17. Jahrhunderts untersuchten Robert William Boyle und Edme Mariotte unabhängig voneinander die Beziehung zwischen Volumen und Druck eines Gases bei konstanter Temperatur . Die Ergebnisse bestimmter Experimente mit Gasen bei relativ niedrigem Druck veranlassten Robert Boyle, ein bekanntes Gesetz zu formulieren. Es sagt, dass:
Bei einer festen Gasmasse bei konstanter Temperatur ist das Volumen umgekehrt proportional zum Druck.
Das heißt, wenn Sie beispielsweise das Volumen zehnmal erhöhen, sinkt der Druck zehnmal. Wenn Sie das Volumen halbieren, verdoppeln Sie den Druck.
Sie können dies mathematisch ausdrücken als:
pV = konstant
oder
p 1 V 1 = p 2 V 2
Ja, es scheint identisch zu sein mit dem isothermen Prozess des idealen Gases. Tatsächlich bleibt die Temperatur während ihrer Experimente konstant, wie von Mariotte angenommen wurde. Diese Ergebnisse stimmen voll und ganz mit dem idealen Gasgesetz überein , das bestimmt, dass die Konstante gleich nRT ist .
pV = nRT
wo:
- p ist der absolute Druck des Gases
- n ist die Substanzmenge
- T ist die absolute Temperatur
- V ist die Lautstärke
- R ist die ideale oder universelle Gaskonstante, die dem Produkt der Boltzmann-Konstante und der Avogadro-Konstante entspricht.
In dieser Gleichung ist das Symbol R eine Konstante, die als universelle Gaskonstante bezeichnet wird und für alle Gase den gleichen Wert hat, nämlich R = 8,31 J / mol K.
Beispiel eines isothermen Prozesses
Nehmen Sie eine isotherme Expansion von Helium (i → f) in einem reibungslosen Kolben (geschlossenes System) an. Die Gasexpansion wird durch Absorption von Wärmeenergie Q add angetrieben . Das Gas dehnt sich ab einem Anfangsvolumen von 0,001 m 3 aus und gleichzeitig nimmt die äußere Belastung des Kolbens langsam und kontinuierlich von 1 MPa auf 0,5 MPa ab. Da sich Helium fast wie ein ideales Gas verhält, verwenden Sie das ideale Gasgesetz, um das Endvolumen der Kammer zu berechnen, und berechnen Sie dann die vom System geleistete Arbeit, wenn die Temperatur des Gases 400 K beträgt.
Lösung:
Das Endvolumen des Gases V f kann unter Verwendung der Beziehung p, V, T für den isothermen Prozess berechnet werden :
p i V i = p f V f⇒ V f = p i V i / p f = 2 × 0,001 m 3 = 0,002 m 3
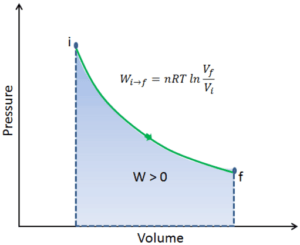
Um solche Prozesse zu berechnen, müssten wir wissen, wie sich der Druck mit dem Volumen für den tatsächlichen Prozess ändert, durch den sich das System von Zustand i zu Zustand f ändert . Da während dieses Vorgangs der Innendruck nicht konstant war, muss die vom Kolben geleistete p∆V- Arbeit mit dem folgenden Integral berechnet werden:
Konventionell bedeutet ein positiver Wert für Arbeit, dass das System an seiner Umgebung arbeitet. Ein negativer Wert zeigt an, dass die Umgebung am System arbeitet. Die pΔV-Arbeit ist gleich der Fläche unter der Prozesskurve, die im Druck-Volumen-Diagramm aufgetragen ist.
Kostenlose Erweiterung – Joule-Erweiterung
Dies sind adiabatische Prozesse, bei denen keine Wärmeübertragung zwischen dem System und seiner Umgebung stattfindet und keine Arbeiten am oder vom System ausgeführt werden. Diese Arten von adiabatischen Prozessen werden als freie Expansion bezeichnet . Es ist ein irreversibler Prozess, bei dem sich ein Gas in eine isolierte evakuierte Kammer ausdehnt. Es wird auch Joule-Erweiterung genannt . Für ein ideales Gas ändert sich die Temperatur nicht (dies bedeutet, dass der Prozess auch isotherm ist ) , jedoch erfahren echte Gase eine Temperaturänderung während der freien Expansion. Bei der freien Expansion ist Q = W = 0, und das erste Gesetz verlangt Folgendes:
dE int = 0
Eine freie Expansion kann nicht in einem PV-Diagramm dargestellt werden, da der Prozess schnell und nicht quasistatisch ist. Die Zwischenzustände sind keine Gleichgewichtszustände, und daher ist der Druck nicht klar definiert.
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.