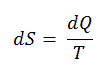Verschiedene Aussagen des Zweiten Hauptsatzes der Thermodynamik
Der zweite Hauptsatz der Thermodynamik kann auf viele spezifische Arten ausgedrückt werden. Jede Aussage drückt das gleiche Gesetz aus. Nachfolgend sind drei aufgeführt, die häufig vorkommen.
Vor diesen Aussagen müssen wir an die Arbeit eines französischen Ingenieurs und Physikers erinnern ,Nicolas Léonard Sadi Carnot, der das Studium des zweiten Gesetzes vorangetrieben hat, indem er ein Prinzip ( auchCarnots Regel genannt ) formuliert hat , das Grenzen für den maximalen Wirkungsgrad festlegt, den eine Wärmekraftmaschine erreichen kann .
Clausius Erklärung des zweiten Gesetzes
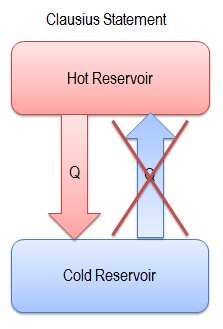 Eine der frühesten Aussagen des zweiten Hauptsatzes der Thermodynamik wurde 1850 von R. Clausius gemacht . Er erklärte Folgendes.
Eine der frühesten Aussagen des zweiten Hauptsatzes der Thermodynamik wurde 1850 von R. Clausius gemacht . Er erklärte Folgendes.
„Es ist unmöglich, ein Gerät zu konstruieren, das in einem Zyklus arbeitet und dessen einzige Wirkung die Übertragung von Wärme von einem kühleren Körper auf einen heißeren Körper ist.“
Wärme kann nicht spontan vom kalten zum heißen System fließen , ohne dass externe Arbeiten am System durchgeführt werden. Genau das leisten Kühlschränke und Wärmepumpen. In einem Kühlschrank fließt die Wärme von kalt nach heiß, aber nur wenn sie durch eine externe Arbeit erzwungen wird, werden Kühlschränke von Elektromotoren angetrieben, für deren Betrieb Arbeiten aus ihrer Umgebung erforderlich sind.
Die Aussagen von Clausius und Kelvin-Planck haben sich als gleichwertig erwiesen.
Kelvin-Planck-Erklärung des zweiten Gesetzes
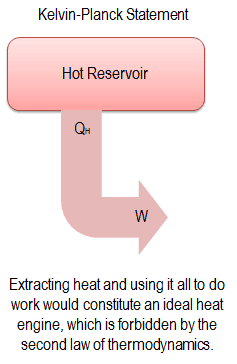 „Es ist unmöglich, ein Gerät zu konstruieren, das in einem Zyklus arbeitet und keinen anderen Effekt als die Erzeugung von Arbeit und die Übertragung von Wärme von einem einzelnen Körper erzeugt.“
„Es ist unmöglich, ein Gerät zu konstruieren, das in einem Zyklus arbeitet und keinen anderen Effekt als die Erzeugung von Arbeit und die Übertragung von Wärme von einem einzelnen Körper erzeugt.“
Diese Aussage wird mit dem Begriff „ Wärmespeicher “ oder „ Einzelspeicher “ bezeichnet. Ein Reservoir ist ein großes Objekt, bei dem die Temperatur konstant bleibt, während Energie extrahiert wird. Ein solches System kann auf verschiedene Weise angenähert werden – durch die Erdatmosphäre, große Gewässer wie Seen, Ozeane und so weiter.
Die Kelvin-Planck-Aussage schließt die Existenz eines Systems nicht aus, das aus einem Wärmeübergang, der aus einem Wärmespeicher entnommen wird, einen Nettoarbeitsaufwand entwickelt. Nach dieser Aussage kann ein System, das einen Zyklus durchläuft, aus einem Wärmeübergang, der aus einem Wärmespeicher entnommen wird, keine positive Nettoarbeitsmenge entwickeln.
Entropie und das zweite Gesetz
Eine Konsequenz des zweiten Hauptsatzes der Thermodynamik ist die Entwicklung der physikalischen Eigenschaft der Materie, die als Entropie (S) bekannt ist . Die Änderung dieser Eigenschaft wird verwendet, um die Richtung zu bestimmen, in die ein bestimmter Prozess abläuft. Die Entropie quantifiziert die Energie einer Substanz, die nicht mehr für nützliche Arbeiten zur Verfügung steht . Dies bezieht sich auf das zweite Gesetz, da das zweite Gesetz vorhersagt, dass nicht die gesamte Wärme, die einem Kreislauf zugeführt wird, in den gleichen Arbeitsaufwand umgewandelt werden kann. Es muss eine gewisse Wärmeabgabe stattfinden.
Siehe auch: Entropie
Nach Clausius wurde die Entropie über die Änderung der Entropie S eines Systems definiert. Die Änderung der Entropie S, wenn ihr durch einen reversiblen Prozess bei konstanter Temperatur eine Wärmemenge Q zugesetzt wird, ist gegeben durch:
Hier ist Q die Energie, die während des Prozesses als Wärme zum oder vom System übertragen wird, und T ist die Temperatur des Systems in Kelvin während des Prozesses. Die SI – Einheit für die Entropie ist J / K .
Der zweite Hauptsatz der Thermodynamik kann auch als ∆S≥0 für einen geschlossenen Kreislauf ausgedrückt werden.
In Worten:
Die Entropie eines isolierten Systems nimmt niemals ab. In einem natürlichen thermodynamischen Prozess nimmt die Summe der Entropien der wechselwirkenden thermodynamischen Systeme zu.
∆S≥0
Da die Entropie so viel über die Nützlichkeit einer bei der Ausführung von Arbeiten übertragenen Wärmemenge aussagt, enthalten die Dampftabellen Werte der spezifischen Entropie (s = S / m) als Teil der tabellierten Informationen.
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.