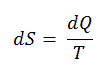Diversas declaraciones de la segunda ley de la termodinámica
La segunda ley de la termodinámica se puede expresar de muchas maneras específicas. Cada declaración expresa la misma ley. A continuación se enumeran tres que a menudo se encuentran.
Antes de estas declaraciones, debemos recordar el trabajo de un ingeniero y físico francés, Nicolas Léonard Sadi Carnot avanzó el estudio de la segunda ley formando un principio ( también llamado la regla de Carnot ) que especifica los límites de la máxima eficiencia que cualquier motor térmico puede obtener .
Declaración de Clausius de la segunda ley
 Una de las primeras declaraciones de la Segunda Ley de la Termodinámica fue hecha por R. Clausius en 1850 . Él dijo lo siguiente.
Una de las primeras declaraciones de la Segunda Ley de la Termodinámica fue hecha por R. Clausius en 1850 . Él dijo lo siguiente.
“Es imposible construir un dispositivo que funcione en un ciclo y cuyo único efecto sea la transferencia de calor de un cuerpo más frío a un cuerpo más caliente”.
El calor no puede fluir espontáneamente del sistema frío al sistema caliente sin realizar un trabajo externo en el sistema. Esto es exactamente lo que logran los refrigeradores y las bombas de calor. En un refrigerador, el calor fluye de frío a caliente, pero solo cuando es forzado por un trabajo externo, los refrigeradores son impulsados por motores eléctricos que requieren trabajo de su entorno para funcionar.
Las declaraciones de Clausius y Kelvin-Planck han demostrado ser equivalentes.
Declaración de Kelvin-Planck de la Segunda Ley
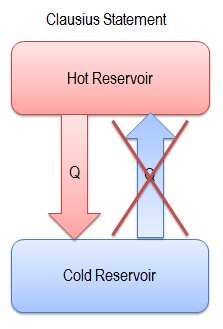
 “Es imposible construir un dispositivo que funcione en un ciclo y no produzca otro efecto que la producción de trabajo y la transferencia de calor de un solo cuerpo”.
“Es imposible construir un dispositivo que funcione en un ciclo y no produzca otro efecto que la producción de trabajo y la transferencia de calor de un solo cuerpo”.
Esta declaración opera con el término ” depósito térmico ” o ” depósito único “. Un depósito es un objeto grande, en el que la temperatura permanece constante mientras se extrae la energía. Tal sistema puede ser aproximado de varias maneras: por la atmósfera de la tierra, grandes cuerpos de agua como lagos, océanos, etc.
La declaración de Kelvin-Planck no excluye la existencia de un sistema, que desarrolla una cantidad neta de trabajo de una transferencia de calor extraída de un depósito térmico. Según esta declaración, un sistema que experimenta un ciclo no puede desarrollar una cantidad neta positiva de trabajo de una transferencia de calor extraída de un depósito térmico.
La entropía y la segunda ley
Una consecuencia de la segunda ley de la termodinámica es el desarrollo de la propiedad física de la materia, que se conoce como entropía (S) . El cambio en esta propiedad se utiliza para determinar la dirección en la que procederá un proceso determinado. La entropía cuantifica la energía de una sustancia que ya no está disponible para realizar un trabajo útil . Esto se relaciona con la segunda ley, ya que la segunda ley predice que no todo el calor proporcionado a un ciclo puede transformarse en una cantidad igual de trabajo, debe producirse un cierto rechazo de calor.
Ver también: entropía
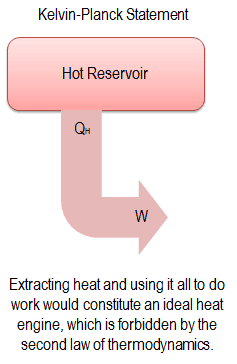
Según Clausius, la entropía se definió mediante el cambio en la entropía S de un sistema. El cambio en la entropía S, cuando se le agrega una cantidad de calor Q mediante un proceso reversible a temperatura constante, viene dado por:
Aquí Q es la energía transferida como calor hacia o desde el sistema durante el proceso, y T es la temperatura del sistema en grados Kelvin durante el proceso. La unidad SI de la entropía es J / K .
La segunda ley de la termodinámica también se puede expresar como ∆S≥0 para un ciclo cerrado.
En palabras:
La entropía de cualquier sistema aislado nunca disminuye. En un proceso termodinámico natural, aumenta la suma de las entropías de los sistemas termodinámicos que interactúan.
≥S≥0
Debido a que la entropía dice mucho acerca de la utilidad de una cantidad de calor transferida en la realización del trabajo, las tablas de vapor incluyen valores de entropía específica (s = S / m) como parte de la información tabulada.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.