Enthalpie in extensiven Einheiten
H = U + pV
Die Enthalpie ist eine große Menge, sie hängt von der Größe des Systems oder von der Menge der darin enthaltenen Substanz ab. Die SI-Einheit der Enthalpie ist das Joule (J). Es ist die im System enthaltene Energie, ohne die kinetische Bewegungsenergie des Gesamtsystems und die potentielle Energie des Gesamtsystems aufgrund externer Kraftfelder. Dies ist die thermodynamische Größe, die dem gesamten Wärmeinhalt eines Systems entspricht.
Andererseits kann Energie in den chemischen Bindungen zwischen den Atomen gespeichert werden, aus denen die Moleküle bestehen. Diese Energiespeicherung auf atomarer Ebene schließt Energie ein, die mit Elektronenorbitalzuständen, Kernspin und Bindungskräften im Kern verbunden ist.
Die Enthalpie wird durch das Symbol H dargestellt , und die Änderung der Enthalpie (Delta H) in einem Prozess ist H 2 – H 1 .
Es gibt Ausdrücke für bekanntere Variablen wie Temperatur und Druck :
dH = C p dT + V (1 & agr; T-) dp
Dabei ist C p die Wärmekapazität bei konstantem Druck und α der (kubische) Wärmeausdehnungskoeffizient. Für ideales Gas αT = 1 und damit:
dH = C p dT
Beispiel: Reibungsloser Kolben – Wärme – Enthalpie

Ein reibungsfreier Kolben wird verwendet, um einen konstanten Druck von 500 kPa in einem Zylinder bereitzustellen , der Dampf ( überhitzten Dampf ) mit einem Volumen von 2 m 3 bei 500 K enthält . Berechnen der Endtemperatur, falls 3000 kJ von Wärme hinzugefügt wird.
Lösung:
Anhand von Dampftabellen wissen wir, dass die spezifische Enthalpie eines solchen Dampfes (500 kPa; 500 K) etwa 2912 kJ / kg beträgt . Da der Dampf unter diesen Bedingungen eine Dichte von 2,2 kg / m 3 hat , wissen wir, dass sich bei einer Enthalpie von 2912 kJ / kg x 4,4 kg = 12812 kJ etwa 4,4 kg Dampf im Kolben befinden .
Wenn wir einfach Q = H 2 – H 1 verwenden , ist die resultierende Dampfenthalpie:
H 2 = H 1 + Q = 15812 kJ
Von Dampftabellen , wie Heißdampf (15812 / 4,4 = 3593 kJ / kg) wird eine Temperatur von haben 828 K (555 ° C) . Da der Dampf bei dieser Enthalpie eine Dichte von 1,31 kg / m 3 hat , ist es offensichtlich, dass er sich um etwa 2,2 / 1,31 = 1,67 (+ 67%) ausgedehnt hat. Daher beträgt das resultierende Volumen 2 m 3 × 1,67 = 3,34 m 3 und ∆V = 3,34 m 3 – 2 m 3 = 1,34 m 3 .
Der p∆V- Teil der Enthalpie, dh die geleistete Arbeit, ist:
W = p∆V = 500 000 Pa × 1,34 m 3 = 670 kJ
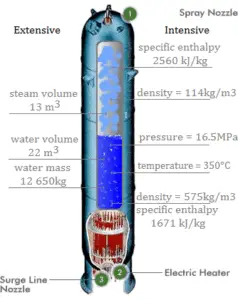
Enthalpie in Intensiveinheiten – Spezifische Enthalpie
Die Enthalpie kann durch Teilen durch die Masse zu einer intensiven oder spezifischen Variablen gemacht werden . Ingenieure verwenden die spezifische Enthalpie in der thermodynamischen Analyse mehr als die Enthalpie selbst. Die spezifische Enthalpie (h) eines Stoffes ist seine Enthalpie pro Masseneinheit. Sie entspricht der Gesamtenthalpie (H) geteilt durch die Gesamtmasse (m).
h = H / m
wo:
h = spezifische Enthalpie (J / kg)
H = Enthalpie (J)
m = Masse (kg)
Beachten Sie, dass die Enthalpie die thermodynamische Größe ist, die dem Gesamtwärmegehalt eines Systems entspricht. Die spezifische Enthalpie entspricht der spezifischen inneren Energie des Systems plus dem Produkt aus Druck und spezifischem Volumen .
h = u + pv
Im Allgemeinen ist die Enthalpie eine Eigenschaft einer Substanz wie Druck, Temperatur und Volumen, kann jedoch nicht direkt gemessen werden. Normalerweise wird die Enthalpie eines Stoffes in Bezug auf einen Referenzwert angegeben. Zum Beispiel wird die spezifische Enthalpie von Wasser oder Dampf unter Verwendung der Referenz angegeben, dass die spezifische Enthalpie von Wasser bei 0,01 ° C und normalem atmosphärischem Druck Null ist , wobei h L = 0,00 kJ / kg ist . Die Tatsache, dass der Absolutwert der spezifischen Enthalpie unbekannt ist, ist jedoch kein Problem, da bei praktischen Problemen die Änderung der spezifischen Enthalpie (∆h) und nicht der Absolutwert wichtig ist.
Enthalpieänderungen in chemischen Reaktionen
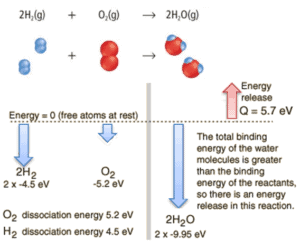
Betrachten Sie die Verbrennung von Wasserstoff in Luft. In einer in Luft brennenden Flamme aus reinem Wasserstoffgas reagiert der Wasserstoff (H 2 ) mit Sauerstoff (O 2 ) unter Bildung von Wasser (H 2 O) und setzt Energie frei .
Energetisch kann davon ausgegangen werden, dass der Prozess die Energie benötigt, um H 2 und O 2 zu dissoziieren , aber dann bringt die Bindung des H 2 O das System in einen gebundenen Zustand mit negativem Potential zurück . Es ist tatsächlich negativer als die gebundenen Zustände der Reaktanten, und die Bildung der beiden Wassermoleküle ist daher eine exotherme Reaktion , die 5,7 eV Energie freisetzt. In Worten der Enthalpie beträgt die Verbrennungsenthalpie –286 kJ / mol:
2H 2 (g) + O 2 (g) → 2H 2 O (g)
In Worten der Enthalpie beträgt die Verbrennungsenthalpie –286 kJ / mol (Energie pro Mol molekularen Wasserstoffs):
2H 2 (g) + O 2 (g) → 2H 2 O ( 1 ) + 572 kJ
Das Gleichgewicht der Energie vor und nach der Reaktion kann schematisch mit dem Zustand dargestellt werden, in dem alle Atome frei sind, als Referenz für die Energie genommen.
Verdampfungsenthalpie
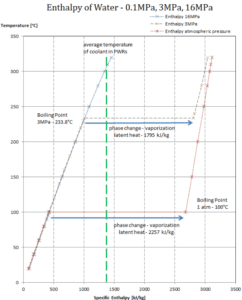
Wenn ein Material die Phase von fest zu flüssig oder von flüssig zu gasförmig ändert, ist im Allgemeinen eine bestimmte Energiemenge an dieser Phasenänderung beteiligt. Im Falle eines Phasenwechsels von Flüssigkeit zu Gas wird diese Energiemenge als Verdampfungsenthalpie (Symbol ∆H vap ; Einheit: J) bezeichnet, die auch als (latente) Verdampfungswärme oder Verdampfungswärme bezeichnet wird. Latente Wärme ist die Wärmemenge, die einer Substanz hinzugefügt oder von ihr entfernt wird, um eine Phasenänderung zu erzeugen. Diese Energie baut die intermolekularen Anziehungskräfte auf und muss auch die Energie liefern, die zur Expansion des Gases erforderlich ist (die pΔV-Arbeit). Wenn latente Wärme hinzugefügt wird, tritt keine Temperaturänderung auf. Die Verdampfungsenthalpie ist eine Funktion des Drucks, bei dem diese Umwandlung stattfindet.
Latente Verdampfungswärme – Wasser mit 0,1 MPa (atmosphärischer Druck)
h lg = 2257 kJ / kg
Latente Verdampfungswärme – Wasser mit 3 MPa (Druck in einem Dampferzeuger)
h lg = 1795 kJ / kg
Verdampfungswärme – Wasser bei 16 MPa (Druck in einem Druckhalter )
h lg = 931 kJ / kg
Die Verdampfungswärme nimmt mit zunehmendem Druck ab, während der Siedepunkt steigt. Es verschwindet vollständig an einem bestimmten Punkt, der als kritischer Punkt bezeichnet wird . Oberhalb des kritischen Punktes sind die flüssige und die dampfförmige Phase nicht zu unterscheiden, und die Substanz wird als überkritische Flüssigkeit bezeichnet .
Die Verdampfungswärme ist die Wärme, die erforderlich ist, um eine Einheit gesättigter Flüssigkeit vollständig zu verdampfen (oder eine Einheit Masse gesättigten Dampfes zu kondensieren) und gleich h lg = h g – h l .
Die Wärme, die erforderlich ist, um eine Masseeinheit an der Substanz bei konstantem Druck zu schmelzen (oder einzufrieren), ist die Schmelzwärme und ist gleich h sl = h l – h s , wobei h s die Enthalpie von gesättigtem Feststoff und h l ist ist die Enthalpie der gesättigten Flüssigkeit.
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.