pΔV Arbeit im pV-Diagramm
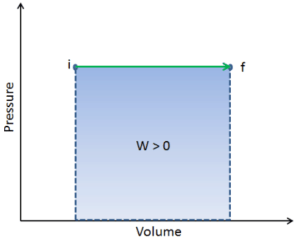
Druck-Volumen-Arbeit (oder pΔV- Arbeit ) tritt auf, wenn sich das Volumen V eines Systems ändert. Die pΔV- Arbeit ist gleich der Fläche unter der Prozesskurve, die im Druck-Volumen-Diagramm aufgetragen ist. Es ist auch als Grenzarbeit bekannt . Grenzarbeit tritt auf, weil die Masse der Substanz, die in der Systemgrenze enthalten ist, eine Kraft, den Druck mal die Oberfläche, auf die Grenzfläche einwirken lässt und sie in Bewegung versetzt. Grenzarbeit (oder pΔV- Arbeit ) tritt auf, wenn sich das Volumen V eines Systems ändert . Es wird zur Berechnung der Kolbenverdrängungsarbeit in einem geschlossenen System verwendet . Dies ist der Fall, wenn sich in einer Kolben-Zylinder-Vorrichtung enthaltener Dampf oder Gas gegen den Kolben ausdehnt und den Kolben zur Bewegung zwingt.
———–
Während der Volumenänderung , der Druck und Temperatur können auch geändert werden . Um solche Prozesse zu berechnen, müssten wir wissen, wie sich der Druck mit dem Volumen für den tatsächlichen Prozess ändert, durch den das System von Zustand i zu Zustand f wechselt . Das erste Hauptsatz der Thermodynamik und der Arbeit kann dann ausgedrückt werden als:
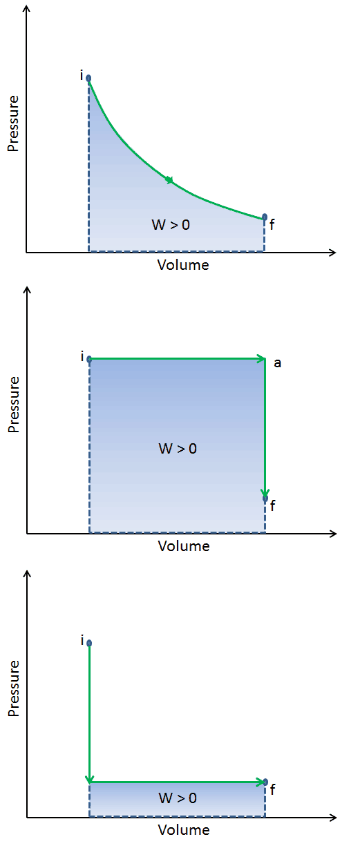
Wenn ein thermodynamisches System von einem Anfangszustand in einen Endzustand übergeht, durchläuft es eine Reihe von Zwischenzuständen . Wir nennen diese Reihe von Zuständen einen Pfad . Für diese Zwischenzustände gibt es immer unendlich viele verschiedene Möglichkeiten. Wenn alle Gleichgewichtszustände vorliegen, kann der Pfad in einem pV-Diagramm aufgezeichnet werden . Eine der wichtigsten Schlussfolgerungen lautet:
Die Arbeit, die das System leistet, hängt nicht nur von den Anfangs- und Endzuständen ab, sondern auch von den Zwischenzuständen, dh vom Pfad.
Q und W sind wegabhängig, während ΔE int wegunabhängig ist. Wie aus dem Bild (pV-Diagramm) ersichtlich, ist die Arbeit eine wegabhängige Variable. Der blaue Bereich repräsentiert die von einem System geleistete pΔV- Arbeit , wenn es von einem Anfangszustand i zu einem Endzustand f übergeht. Arbeit W ist positiv, weil die Lautstärke des Systems zunimmt. Der zweite Prozess zeigt, dass die Arbeit größer ist und vom Prozesspfad abhängt.
Darüber hinaus können wir das System durch eine Reihe von Zuständen führen, die eine geschlossene Schleife bilden , wie i ⇒ f ⇒ i . In diesem Fall ist der Endzustand derselbe wie der Anfangszustand , aber die vom System geleistete Gesamtarbeit ist nicht Null . Ein positiver Wert für Arbeit zeigt an, dass das System in seiner Umgebung Arbeiten ausführt. Ein negativer Wert zeigt an, dass Arbeiten an dem System von seiner Umgebung ausgeführt werden.
Beispiel: Erster Hauptsatz der Thermodynamik und des Brayton-Zyklus
Nehmen wir den idealen Brayton-Zyklus an , der die Funktionsweise einer Wärmekraftmaschine mit konstantem Druck beschreibt . Moderne Gasturbinentriebwerke und luftatmende Strahltriebwerke folgen ebenfalls dem Brayton-Zyklus. Dieser Zyklus besteht aus vier thermodynamischen Prozessen:
-

Der ideale Brayton-Zyklus besteht aus vier thermodynamischen Prozessen. Zwei isentrope Prozesse und zwei isobare Prozesse. isentropische Kompression – Umgebungsluft wird in den Kompressor gesaugt und dort unter Druck gesetzt (1 → 2). Die für den Kompressor erforderliche Arbeit ist gegeben durch W C = H 2 – H 1 .
- isobare Wärmezufuhr – Die Druckluft strömt dann durch eine Brennkammer, in der Kraftstoff verbrannt und Luft oder ein anderes Medium erwärmt wird (2 → 3). Es ist ein Prozess mit konstantem Druck, da die Kammer zum Ein- und Ausströmen geöffnet ist. Die hinzugefügte Nettowärme ist gegeben durch Q add = H 3 – H 2
- isentropische Expansion – Die erwärmte Druckluft dehnt sich dann auf der Turbine aus und gibt ihre Energie ab. Die von der Turbine geleistete Arbeit ist gegeben durch W T = H 4 – H 3
- isobare Wärmeabgabe – Die Restwärme muss abgeführt werden, um den Kreislauf zu schließen. Die abgegebene Nettowärme ist gegeben durch Q re = H 4 – H 1
Wie zu sehen ist, können wir solche Kreisprozessen (ähnlich für den Rankine-Zyklus ) unter Verwendung von Enthalpien beschreiben und berechnen (z. B. thermodynamische Effizienz) .
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.
