Trabalho pΔV no diagrama pV
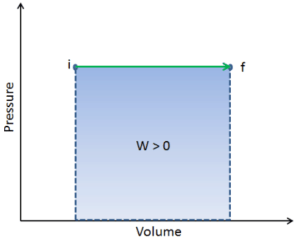
O trabalho pressão-volume (ou pΔV Work ) ocorre quando o volume V de um sistema é alterado. O trabalho pΔV é igual à área sob a curva do processo plotada no diagrama pressão-volume. É conhecido também como o trabalho de fronteira . O trabalho de limite ocorre porque a massa da substância contida no limite do sistema faz com que uma força, a pressão vezes a área da superfície, atue na superfície do limite e faça com que ela se mova. O trabalho de limite (ou pΔV Work ) ocorre quando o volume V de um sistema é alterado . É usado para calcular o trabalho de deslocamento do pistão em um sistema fechado . É o que acontece quando o vapor ou o gás contido em um dispositivo de cilindro e pistão se expande contra o pistão e força o pistão a se mover.
———–
Durante a mudança de volume , a pressão e a temperatura também podem mudar. Para calcular esses processos, precisaríamos saber como a pressão varia com o volume do processo real pelo qual o sistema muda do estado i para o estado f . A primeira lei da termodinâmica e o trabalho podem ser expressos como:
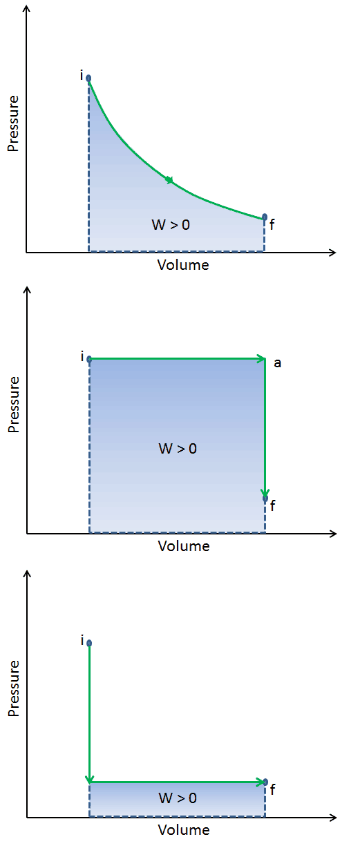
Quando um sistema termodinâmico muda de um estado inicial para um estado final , passa por uma série de estados intermediários . Chamamos essa série de estados de caminho . Sempre existem infinitamente muitas possibilidades diferentes para esses estados intermediários. Quando todos eles são estados de equilíbrio, o caminho pode ser plotado em um diagrama de pV . Uma das conclusões mais importantes é que:
O trabalho realizado pelo sistema depende não apenas dos estados inicial e final, mas também dos estados intermediários – ou seja, no caminho.
Q e W são dependentes do caminho, enquanto ΔE int é independente do caminho. Como pode ser visto na figura (diagrama pV), o trabalho é variável dependente do caminho. A área azul representa o trabalho pΔV realizado por um sistema, que passa de um estado inicial i para um estado final f. O trabalho W é positivo porque o volume do sistema aumenta. O segundo processo mostra que o trabalho é maior e depende do caminho do processo.
Além disso, podemos conduzir o sistema através de uma série de estados formando um circuito fechado , como i ⇒ f ⇒ i . Nesse caso, o estado final é o mesmo que o estado inicial , mas o trabalho total realizado pelo sistema não é zero . Um valor positivo para o trabalho indica que o trabalho é realizado pelo sistema em seus arredores. Um valor negativo indica que o trabalho é realizado no sistema por seus arredores.
Exemplo: Primeira Lei da Termodinâmica e Ciclo de Brayton
Vamos assumir o ciclo de Brayton ideal que descreve o funcionamento de um motor de calor com pressão constante . Os modernos motores de turbina a gás e os motores a jato de respiração também seguem o ciclo de Brayton. Esse ciclo consiste em quatro processos termodinâmicos:
-

O ciclo ideal de Brayton consiste em quatro processos termodinâmicos. Dois processos isentrópicos e dois processos isobáricos. compressão isentrópica – o ar ambiente é aspirado para o compressor, onde é pressurizado (1 → 2). O trabalho necessário para o compressor é dado por W C = H 2 – H 1 .
- adição de calor isobárico – o ar comprimido passa por uma câmara de combustão, onde o combustível é queimado e o ar ou outro meio é aquecido (2 → 3). É um processo de pressão constante, já que a câmara está aberta para entrar e sair. O calor líquido adicionado é dado por Q add = H 3 – H 2
- expansão isentrópica – o ar aquecido e pressurizado se expande na turbina, gasta sua energia. O trabalho realizado pela turbina é dado por W T = H 4 – H 3
- rejeição de calor isobárica – o calor residual deve ser rejeitado para fechar o ciclo. O calor líquido rejeitado é dado por Q re = H 4 – H 1
Como pode ser visto, podemos descrever e calcular (por exemplo, eficiência termodinâmica) esses ciclos (da mesma forma para o ciclo de Rankine ) usando entalpias .
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.
