pAV Travailler en diagramme pV
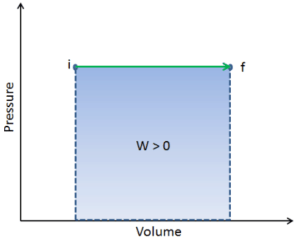
Le travail pression-volume (ou travail pΔV ) se produit lorsque le volume V d’un système change. Le travail pΔV est égal à l’aire sous la courbe de processus tracée sur le diagramme pression-volume. Il est également connu comme le travail de frontière . Le travail aux limites se produit parce que la masse de la substance contenue dans la limite du système entraîne une force, la pression multipliée par la surface, à agir sur la surface limite et à la faire bouger. Le travail aux limites (ou travail pΔV ) se produit lorsque le volume V d’un système change . Il est utilisé pour calculer le travail de déplacement de piston dans un système fermé . C’est ce qui se produit lorsque de la vapeur ou du gaz contenu dans un dispositif piston-cylindre se dilate contre le piston et force le piston à se déplacer.
———–
Pendant le changement de volume , la pression et la température peuvent également changer. Pour calculer de tels processus, nous aurions besoin de savoir comment la pression varie en fonction du volume du processus réel selon lequel le système passe de l’état i à l’état f . La première loi de la thermodynamique et du travail peut alors être exprimée comme suit:
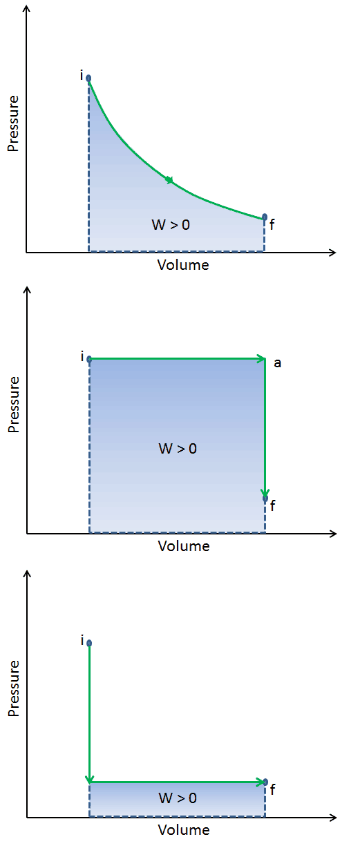
Lorsqu’un système thermodynamique passe d’un état initial à un état final , il passe par une série d’états intermédiaires . Nous appelons cette série d’états un chemin . Il y a toujours une infinité de possibilités différentes pour ces états intermédiaires. Quand ils sont tous à l’état d’équilibre, le chemin peut être tracé sur un diagramme pV . L’une des conclusions les plus importantes est que:
Le travail effectué par le système dépend non seulement des états initial et final, mais également des états intermédiaires, c’est-à-dire du chemin.
Q et W dépendent du chemin, alors que ΔE int est indépendant du chemin. Comme on peut le voir sur l’image (diagramme pV), le travail est une variable dépendante du chemin. La zone bleue représente le travail pΔV effectué par un système lorsqu’il passe d’un état initial i à un état final f. Work W est positif car le volume du système augmente. Le deuxième processus montre que le travail est plus important et que cela dépend de la trajectoire du processus.
De plus, nous pouvons faire passer le système à travers une série d’états formant une boucle fermée , telle que i ⇒ f ⇒ i . Dans ce cas, l’ état final est identique à l’état initial , mais le travail total effectué par le système n’est pas nul . Une valeur de travail positive indique que le système effectue le travail sur son environnement. Une valeur négative indique que le travail est effectué sur le système en fonction de son environnement.
Exemple: Première loi de la thermodynamique et cycle de Brayton
Supposons le cycle de Brayton idéal qui décrit le fonctionnement d’un moteur thermique à pression constante . Les moteurs à turbine à gaz modernes et les moteurs à réaction à respiration aérodynamique suivent également le cycle de Brayton. Ce cycle comprend quatre processus thermodynamiques:

- compression isentropique – l’air ambiant est aspiré dans le compresseur, où il est mis sous pression (1 → 2). Le travail requis pour le compresseur est donné par W C = H 2 – H 1 .
- addition de chaleur isobare – l’air comprimé traverse ensuite une chambre de combustion, où le combustible est brûlé et l’air ou un autre milieu est chauffé (2 → 3). Il s’agit d’un processus à pression constante, car la chambre est ouverte pour entrer et sortir. La chaleur nette ajoutée est donnée par Q add = H 3 – H 2
- expansion isentropique – l’air chauffé sous pression se détend ensuite sur la turbine, cède son énergie. Le travail effectué par turbine est donné par W T = H 4 – H 3
- rejet de chaleur isobare – la chaleur résiduelle doit être rejetée afin de fermer le cycle. La chaleur nette rejetée est donnée par Q re = H 4 – H 1
Comme on peut le voir, nous pouvons décrire et calculer (par exemple l’efficacité thermodynamique) de tels cycles (de même pour le cycle de Rankine ) en utilisant des enthalpies .
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci
