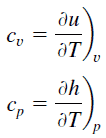Calor en termodinámica
 Mientras que la energía interna se refiere a la energía total de todas las moléculas dentro del objeto, el calor es la cantidad de energía que fluye de un cuerpo a otro de forma espontánea debido a su diferencia de temperatura. El calor es una forma de energía, pero es energía en tránsito . El calor no es una propiedad de un sistema. Sin embargo, la transferencia de energía como calor ocurre a nivel molecular como resultado de una diferencia de temperatura .
Mientras que la energía interna se refiere a la energía total de todas las moléculas dentro del objeto, el calor es la cantidad de energía que fluye de un cuerpo a otro de forma espontánea debido a su diferencia de temperatura. El calor es una forma de energía, pero es energía en tránsito . El calor no es una propiedad de un sistema. Sin embargo, la transferencia de energía como calor ocurre a nivel molecular como resultado de una diferencia de temperatura .
Considere un bloque de metal a alta temperatura, que consiste en átomos que oscilan intensamente alrededor de sus posiciones promedio. A bajas temperaturas , los átomos continúan oscilando, pero con menos intensidad . Si un bloque de metal más caliente se pone en contacto con un bloque más frío, los átomos que oscilan intensamente en el borde del bloque más caliente emiten su energía cinética a los átomos menos oscilantes en el borde del bloque frío. En este caso, hay una transferencia de energía entre estos dos bloques y el calor fluye del bloque más caliente al más frío por estas vibraciones aleatorias.
En general, cuando dos objetos se ponen en contacto térmico , el calor fluirá entre ellos hasta que se equilibren entre sí. Cuando existe una diferencia de temperatura , el calor fluye espontáneamente del sistema más cálido al sistema más frío . La transferencia de calor ocurre por conducción o por radiación térmica . Cuando se detiene el flujo de calor , se dice que están a la misma temperatura . Luego se dice que están en equilibrio térmico .
Al igual que con el trabajo, la cantidad de calor transferido depende de la ruta y no simplemente de las condiciones iniciales y finales del sistema. En realidad, hay muchas maneras de llevar el gas del estado i al estado f.
Además, como con el trabajo, es importante distinguir entre el calor agregado a un sistema de su entorno y el calor eliminado de un sistema a su entorno. Q es positivo para el calor agregado al sistema, por lo que si el calor sale del sistema, Q es negativo. Debido a que W en la ecuación es el trabajo realizado por el sistema, entonces si el trabajo se realiza en el sistema, W será negativo y E int aumentará.
El símbolo q a veces se usa para indicar el calor agregado o eliminado de un sistema por unidad de masa . Es igual al calor total (Q) agregado o eliminado dividido por la masa (m).
Capacidad calorífica
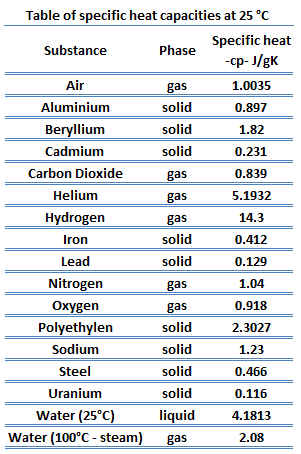 Las diferentes sustancias se ven afectadas a diferentes magnitudes por la adición de calor . Cuando se agrega una cantidad determinada de calor a diferentes sustancias, sus temperaturas aumentan en diferentes cantidades. Esta constante de proporcionalidad entre el calor Q que el objeto absorbe o pierde y el cambio de temperatura resultante T del objeto se conoce como la capacidad calorífica C de un objeto.
Las diferentes sustancias se ven afectadas a diferentes magnitudes por la adición de calor . Cuando se agrega una cantidad determinada de calor a diferentes sustancias, sus temperaturas aumentan en diferentes cantidades. Esta constante de proporcionalidad entre el calor Q que el objeto absorbe o pierde y el cambio de temperatura resultante T del objeto se conoce como la capacidad calorífica C de un objeto.
C = Q / ΔT
La capacidad calorífica es una propiedad extensa de la materia, lo que significa que es proporcional al tamaño del sistema. La capacidad calorífica C tiene la unidad de energía por grado o energía por kelvin. Cuando se expresa el mismo fenómeno que una propiedad intensiva , la capacidad calorífica se divide por la cantidad de sustancia, masa o volumen, por lo que la cantidad es independiente del tamaño o extensión de la muestra.
Capacidad calorífica específica
La capacidad calorífica de una sustancia por unidad de masa se denomina capacidad calorífica específica (c p ) de la sustancia. El subíndice p indica que la capacidad calorífica y la capacidad calorífica específica se aplican cuando el calor se agrega o elimina a presión constante .
c p = Q / mΔT
Capacidad calorífica específica
En el modelo de gas ideal , las propiedades intensivas c v y c p se definen para sustancias compresibles puras y simples como derivadas parciales de la energía interna u (T, v) y entalpía h (T, p) , respectivamente:
donde los subíndices v y p denotan las variables mantenidas fijas durante la diferenciación. Las propiedades c v y c p se denominan calores específicos (o capacidades de calor ) porque, bajo ciertas condiciones especiales, relacionan el cambio de temperatura de un sistema con la cantidad de energía agregada por la transferencia de calor. Sus unidades SI son J / kg K o J / mol K . Se definen dos calores específicos para gases, uno para volumen constante (c v ) y otro para presión constante (c p ) .
 Según la primera ley de la termodinámica , para un proceso de volumen constante con un gas ideal monoatómico, el calor específico molar será:
Según la primera ley de la termodinámica , para un proceso de volumen constante con un gas ideal monoatómico, el calor específico molar será:
C v = 3 / 2R = 12.5 J / mol K
porque
U = 3 / 2nRT
Se puede deducir que el calor específico molar a presión constante es:
C p = C v + R = 5 / 2R = 20.8 J / mol K
Este C p es mayor que el calor específico molar a volumen constante C v , porque ahora se debe suministrar energía no solo para elevar la temperatura del gas sino también para que el gas funcione porque en este caso el volumen cambia.
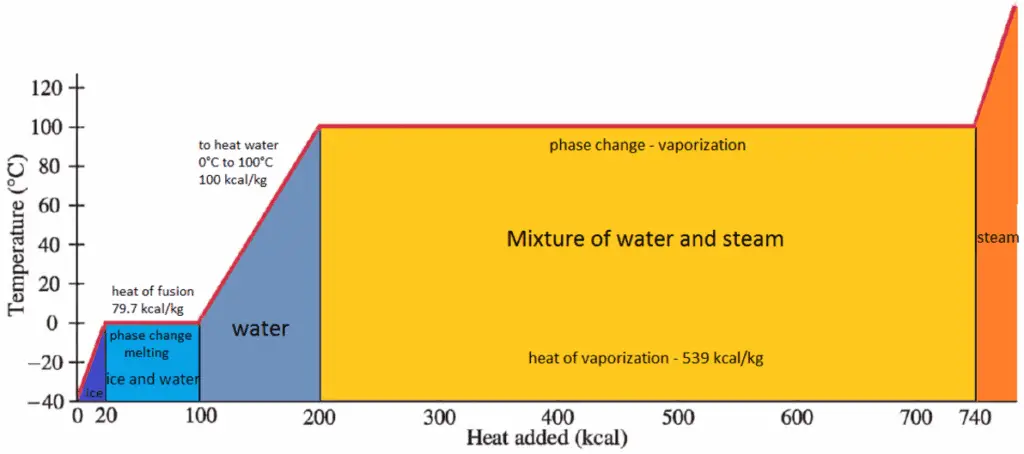
Calor latente de vaporización
En general, cuando un material cambia de fase de sólido a líquido, o de líquido a gas, una cierta cantidad de energía está involucrada en este cambio de fase. En caso de cambio de fase de líquido a gas, esta cantidad de energía se conoce como entalpía de vaporización , (símbolo ∆H vap ; unidad: J) también conocido como calor (latente) de vaporización o calor de evaporación. El calor latente es la cantidad de calor agregado o eliminado de una sustancia para producir un cambio de fase. Esta energía descompone las fuerzas de atracción intermoleculares, y también debe proporcionar la energía necesaria para expandir el gas (el trabajo pΔV) Cuando se agrega calor latente, no ocurre cambio de temperatura. La entalpía de la vaporización es una función de la presión a la que tiene lugar esa transformación.
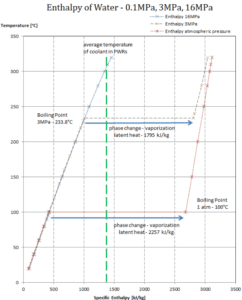
Calor latente de vaporización – agua a 0.1 MPa (presión atmosférica)
h lg = 2257 kJ / kg
Calor latente de vaporización: agua a 3 MPa (presión dentro de un generador de vapor)
h lg = 1795 kJ / kg
Calor latente de vaporización: agua a 16 MPa (presión dentro de un presurizador )
h lg = 931 kJ / kg
El calor de vaporización disminuye al aumentar la presión, mientras que aumenta el punto de ebullición . Se desvanece por completo en un cierto punto llamado punto crítico . Por encima del punto crítico, las fases líquida y de vapor son indistinguibles, y la sustancia se llama fluido supercrítico .
El calor de vaporización es el calor requerido para vaporizar completamente una unidad de líquido saturado (o condensar una unidad de masa de vapor saturado) y es igual a h lg = h g – h l .
El calor necesario para derretir (o congelar) una unidad de masa en la sustancia a presión constante es el calor de fusión y es igual a h sl = h l – h s , donde h s es la entalpía del sólido saturado y h l Es la entalpía del líquido saturado.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.