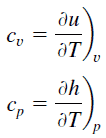Wärme in der Thermodynamik
 Während sich innere Energie auf die Gesamtenergie aller Moleküle im Objekt bezieht, ist Wärme die Energiemenge, die aufgrund ihrer Temperaturdifferenz spontan von einem Körper zum anderen fließt . Wärme ist eine Energieform, aber es ist Energie auf der Durchreise . Wärme ist keine Eigenschaft eines Systems. Die Energieübertragung als Wärme erfolgt jedoch auf molekularer Ebene aufgrund eines Temperaturunterschieds .
Während sich innere Energie auf die Gesamtenergie aller Moleküle im Objekt bezieht, ist Wärme die Energiemenge, die aufgrund ihrer Temperaturdifferenz spontan von einem Körper zum anderen fließt . Wärme ist eine Energieform, aber es ist Energie auf der Durchreise . Wärme ist keine Eigenschaft eines Systems. Die Energieübertragung als Wärme erfolgt jedoch auf molekularer Ebene aufgrund eines Temperaturunterschieds .
Stellen Sie sich einen Metallblock bei hoher Temperatur vor, der aus Atomen besteht, die stark um ihre durchschnittliche Position schwingen. Bei niedrigen Temperaturen schwingen die Atome weiter, jedoch mit geringerer Intensität . Wenn ein heißerer Metallblock mit einem kühleren Block in Kontakt gebracht wird, geben die stark schwingenden Atome am Rand des heißeren Blocks ihre kinetische Energie an die weniger schwingenden Atome am Rand des kühlen Blocks ab. In diesem Fall findet zwischen diesen beiden Blöcken ein Energietransfer statt , und durch diese zufälligen Vibrationen fließt Wärme vom heißeren zum kühleren Block.
Wenn zwei Objekte in thermischen Kontakt gebracht werden , fließt im Allgemeinen Wärme zwischen ihnen, bis sie miteinander ins Gleichgewicht kommen . Wenn eine Temperaturdifferenz vorliegt, fließt Wärme spontan vom wärmeren zum kälteren System . Die Wärmeübertragung erfolgt durch Wärmeleitung oder durch Wärmestrahlung . Wenn der Wärmestrom aufhört , sollen sie die gleiche Temperatur haben . Sie sollen sich dann im thermischen Gleichgewicht befinden .
Wie bei der Arbeit hängt die übertragene Wärmemenge vom Weg ab und nicht nur von den Anfangs- und Endbedingungen des Systems. Es gibt tatsächlich viele Möglichkeiten, das Gas von Zustand i zu Zustand f zu bringen.
Ebenso wie bei der Arbeit ist es wichtig, zwischen Wärme , die einem System von seiner Umgebung zugeführt wird, und Wärme, die von einem System an seine Umgebung abgegeben wird, zu unterscheiden. Q ist positiv für die dem System zugeführte Wärme. Wenn also Wärme aus dem System austritt, ist Q negativ. Da W in der Gleichung die vom System geleistete Arbeit ist, ist W negativ und E int steigt an , wenn am System gearbeitet wird.
Das Symbol q wird manchmal verwendet, um die Wärme anzuzeigen, die einem System pro Masseneinheit hinzugefügt oder daraus entnommen wird . Sie entspricht der zugesetzten oder abgeführten Gesamtwärme (Q) geteilt durch die Masse (m).
Wärmekapazität
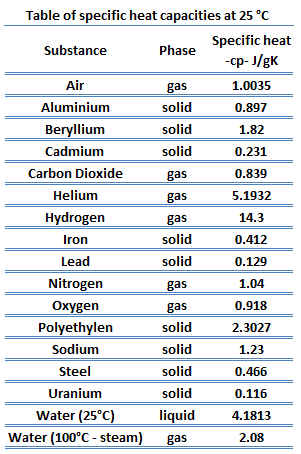 Verschiedene Substanzen sind betroffen unterschiedliche Größen durch die Zugabe von Wärme . Wenn verschiedenen Substanzen eine bestimmte Wärmemenge zugesetzt wird, steigen ihre Temperaturen um unterschiedliche Beträge. Diese Proportionalitätskonstante zwischen der Wärme Q , die das Objekt aufnimmt oder verliert, und der daraus resultierenden Temperaturänderung T des Objekts wird als Wärmekapazität C eines Objekts bezeichnet.
Verschiedene Substanzen sind betroffen unterschiedliche Größen durch die Zugabe von Wärme . Wenn verschiedenen Substanzen eine bestimmte Wärmemenge zugesetzt wird, steigen ihre Temperaturen um unterschiedliche Beträge. Diese Proportionalitätskonstante zwischen der Wärme Q , die das Objekt aufnimmt oder verliert, und der daraus resultierenden Temperaturänderung T des Objekts wird als Wärmekapazität C eines Objekts bezeichnet.
C = Q / ΔT
Die Wärmekapazität ist eine umfangreiche Eigenschaft der Materie, dh sie ist proportional zur Größe des Systems. Die Wärmekapazität C hat die Energieeinheit pro Grad oder Energie pro Kelvin. Wenn das gleiche Phänomen wie eine intensive Eigenschaft ausgedrückt wird , wird die Wärmekapazität durch die Menge an Substanz, Masse oder Volumen geteilt, sodass die Menge unabhängig von der Größe oder dem Ausmaß der Probe ist.
Spezifische Wärmekapazität
Die Wärmekapazität eines Stoffes pro Masseneinheit wird als spezifische Wärmekapazität (c p ) des Stoffes bezeichnet. Der Index p gibt an, dass die Wärmekapazität und die spezifische Wärmekapazität gelten, wenn die Wärme bei konstantem Druck hinzugefügt oder abgeführt wird .
c p = Q / m & Dgr; T.
Spezifische Wärmekapazität
Im Idealgasmodell werden die intensiven Eigenschaften c v und c p für reine, einfache kompressible Substanzen als partielle Ableitungen der inneren Energie u (T, v) bzw. der Enthalpie h (T, p) definiert :
wobei die Indizes v und p die Variablen bezeichnen, die während der Differenzierung festgehalten werden. Die Eigenschaften c v und c p werden als spezifische Wärme (oder Wärmekapazität ) bezeichnet, da sie unter bestimmten besonderen Bedingungen die Temperaturänderung eines Systems mit der durch Wärmeübertragung hinzugefügten Energiemenge in Beziehung setzen. Ihre SI – Einheiten sind J / kg K oder J / mol K . Für Gase sind zwei spezifische Wärmemengen definiert, eine für konstantes Volumen (c v ) und eine für konstanten Druck (c p ) .
 Nach dem ersten Hauptsatz der Thermodynamik beträgt für einen Prozess mit konstantem Volumen mit einem einatomigen idealen Gas die molare spezifische Wärme:
Nach dem ersten Hauptsatz der Thermodynamik beträgt für einen Prozess mit konstantem Volumen mit einem einatomigen idealen Gas die molare spezifische Wärme:
C v = 3 / 2R = 12,5 J / mol K.
da
U = 3 / 2nRT
Es kann abgeleitet werden, dass die molare spezifische Wärme bei konstantem Druck ist:
C p = C v + R = 5 / 2R = 20,8 J / mol K.
Dieses C p ist größer als die molare spezifische Wärme bei konstantem Volumen C v , da nun nicht nur Energie zugeführt werden muss , um die Temperatur des Gases zu erhöhen, sondern auch, damit das Gas funktioniert, da sich in diesem Fall das Volumen ändert.
Latente Verdampfungswärme
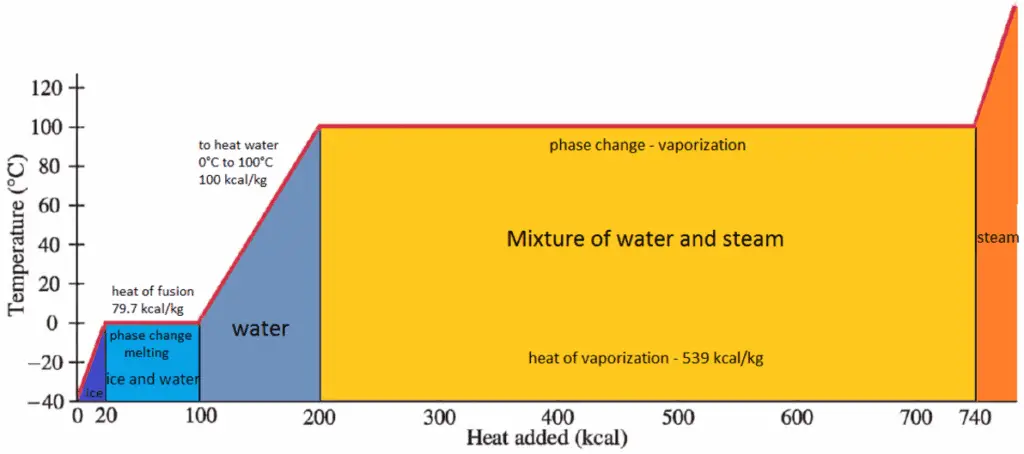
Wenn ein Material die Phase von fest zu flüssig oder von flüssig zu gasförmig ändert, ist im Allgemeinen eine bestimmte Energiemenge an dieser Phasenänderung beteiligt. Im Falle eines Phasenwechsels von Flüssigkeit zu Gas wird diese Energiemenge als Verdampfungsenthalpie (Symbol ∆H vap ; Einheit: J) bezeichnet, die auch als (latente) Verdampfungswärme oder Verdampfungswärme bezeichnet wird. Latente Wärme ist die Wärmemenge, die einer Substanz hinzugefügt oder von ihr entfernt wird, um eine Phasenänderung zu erzeugen. Diese Energie baut die intermolekularen Anziehungskräfte auf und muss auch die Energie liefern, die zur Expansion des Gases erforderlich ist (die pΔV-Arbeit). Wenn latente Wärme hinzugefügt wird, tritt keine Temperaturänderung auf. Die Verdampfungsenthalpie ist eine Funktion des Drucks, bei dem diese Umwandlung stattfindet.
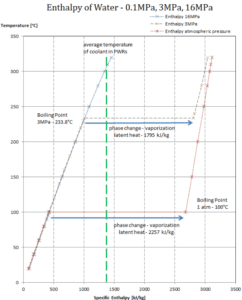
Latente Verdampfungswärme – Wasser mit 0,1 MPa (atmosphärischer Druck)
h lg = 2257 kJ / kg
Latente Verdampfungswärme – Wasser mit 3 MPa (Druck in einem Dampferzeuger)
h lg = 1795 kJ / kg
Verdampfungswärme – Wasser bei 16 MPa (Druck in einem Druckhalter )
h lg = 931 kJ / kg
Die Verdampfungswärme nimmt mit zunehmendem Druck ab, während der Siedepunkt steigt. Es verschwindet vollständig an einem bestimmten Punkt, der als kritischer Punkt bezeichnet wird . Oberhalb des kritischen Punktes sind die flüssige und die dampfförmige Phase nicht zu unterscheiden, und die Substanz wird als überkritische Flüssigkeit bezeichnet .
Die Verdampfungswärme ist die Wärme, die erforderlich ist, um eine Einheit gesättigter Flüssigkeit vollständig zu verdampfen (oder eine Einheit Masse gesättigten Dampfes zu kondensieren) und gleich h lg = h g – h l .
Die Wärme, die erforderlich ist, um eine Masseeinheit an der Substanz bei konstantem Druck zu schmelzen (oder einzufrieren), ist die Schmelzwärme und ist gleich h sl = h l – h s , wobei h s die Enthalpie von gesättigtem Feststoff und h l ist ist die Enthalpie der gesättigten Flüssigkeit.
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.