Saturación
 En termodinámica, el término saturación define una condición en la que puede existir una mezcla de vapor y líquido a una temperatura y presión determinadas. La temperatura a la que comienza a producirse vaporización (ebullición) para una presión determinada se denomina temperatura de saturación o punto de ebullición . La presión a la que comienza a producirse vaporización (ebullición) para una temperatura dada se denomina presión de saturación.
En termodinámica, el término saturación define una condición en la que puede existir una mezcla de vapor y líquido a una temperatura y presión determinadas. La temperatura a la que comienza a producirse vaporización (ebullición) para una presión determinada se denomina temperatura de saturación o punto de ebullición . La presión a la que comienza a producirse vaporización (ebullición) para una temperatura dada se denomina presión de saturación.
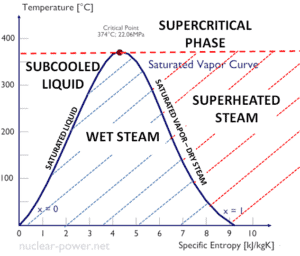
Cuando la calidad del vapor es igual a 0, se denomina estado líquido saturado (monofásico). Por otro lado, cuando la calidad del vapor es igual a 1, se denomina estado de vapor saturado o vapor seco (monofásico). Entre estos dos estados, hablamos de la mezcla vapor-líquido o vapor húmedo (mezcla de dos fases). A presión constante, una adición de energía no cambia la temperatura de la mezcla, pero la calidad del vapor y el volumen específico cambian.
Los parámetros en los que se produce la saturación de agua se tabulan en las llamadas ” tablas de vapor “. En estas tablas, las propiedades básicas y clave, como la presión, la temperatura, la entalpía, la densidad y el calor específico, se tabulan a lo largo de la curva de saturación vapor-líquido en función de la temperatura y la presión.
Ver también: Tablas de vapor
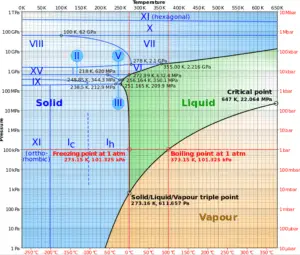
Por ejemplo: en el presurizador de reactores de agua a presión, la temperatura de saturación es de aproximadamente 350 ° C, pero esto corresponde a la presión de 16,4 MPa, que debe mantenerse en el circuito primario. Para una sustancia pura hay una relación definida entre la presión de saturación y la temperatura de saturación. Cuanto mayor es la presión, mayor es la temperatura de saturación. La representación gráfica de esta relación entre temperatura y presión en condiciones saturadas se llama curva de presión de vapor y se puede ver en el diagrama de fase del agua . Este diagrama se muestra en la figura.
Diagrama de fase del agua.
Fuente: wikipedia.org CC BY-SA
Entalpía específica de vapor húmedo
La entalpía específica de agua líquida saturada (x = 0) y vapor seco (x = 1) se puede recoger de las mesas de vapor. En caso de vapor húmedo , la entalpía real se puede calcular con la calidad del vapor, x, y las entalpías específicas de agua líquida saturada y vapor seco:
h húmedo = h s x + (1 – x) h l
dónde
h húmedo = entalpía de vapor húmedo (J / kg)
h s = entalpía de vapor “seco” (J / kg)
h l = entalpía de agua líquida saturada (J / kg)
Como se puede ver, el vapor húmedo siempre tendrá una entalpía más baja que el vapor seco.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.