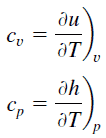Capacidad calorífica
 Las diferentes sustancias se ven afectadas a diferentes magnitudes por la adición de calor . Cuando se agrega una cantidad determinada de calor a diferentes sustancias, sus temperaturas aumentan en diferentes cantidades. Esta constante de proporcionalidad entre el calor Q que el objeto absorbe o pierde y el cambio de temperatura resultante T del objeto se conoce como la capacidad calorífica C de un objeto.
Las diferentes sustancias se ven afectadas a diferentes magnitudes por la adición de calor . Cuando se agrega una cantidad determinada de calor a diferentes sustancias, sus temperaturas aumentan en diferentes cantidades. Esta constante de proporcionalidad entre el calor Q que el objeto absorbe o pierde y el cambio de temperatura resultante T del objeto se conoce como la capacidad calorífica C de un objeto.
C = Q / ΔT
La capacidad calorífica es una propiedad extensa de la materia, lo que significa que es proporcional al tamaño del sistema. La capacidad calorífica C tiene la unidad de energía por grado o energía por kelvin. Cuando se expresa el mismo fenómeno que una propiedad intensiva , la capacidad calorífica se divide por la cantidad de sustancia, masa o volumen, por lo que la cantidad es independiente del tamaño o extensión de la muestra.
Capacidad calorífica específica
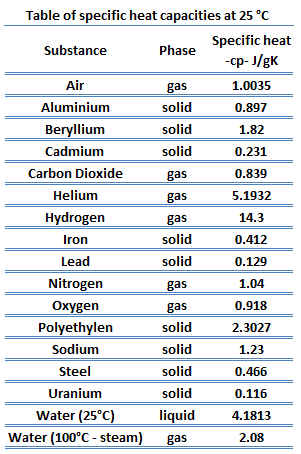
La capacidad calorífica de una sustancia por unidad de masa se denomina capacidad calorífica específica (c p ) de la sustancia. El subíndice p indica que la capacidad calorífica y la capacidad calorífica específica se aplican cuando el calor se agrega o elimina a presión constante .
c p = Q / mΔT
Capacidad calorífica específica del gas ideal
En el modelo de gas ideal , las propiedades intensivas c v y c p se definen para sustancias compresibles puras y simples como derivadas parciales de la energía interna u (T, v) y entalpía h (T, p) , respectivamente:
donde los subíndices v y p denotan las variables mantenidas fijas durante la diferenciación. Las propiedades c v y c p se denominan calores específicos (o capacidades de calor ) porque, bajo ciertas condiciones especiales, relacionan el cambio de temperatura de un sistema con la cantidad de energía agregada por la transferencia de calor. Sus unidades SI son J / kg K o J / mol K . Se definen dos calores específicos para gases, uno para volumen constante (c v ) y otro para presión constante (c p ) .
 Según la primera ley de la termodinámica , para un proceso de volumen constante con un gas ideal monoatómico, el calor específico molar será:
Según la primera ley de la termodinámica , para un proceso de volumen constante con un gas ideal monoatómico, el calor específico molar será:
C v = 3 / 2R = 12.5 J / mol K
porque
U = 3 / 2nRT
Se puede deducir que el calor específico molar a presión constante es:
C p = C v + R = 5 / 2R = 20.8 J / mol K
Este C p es mayor que el calor específico molar a volumen constante C v , porque ahora se debe suministrar energía no solo para elevar la temperatura del gas sino también para que el gas funcione porque en este caso el volumen cambia.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.