Principe zéro de la thermodynamique
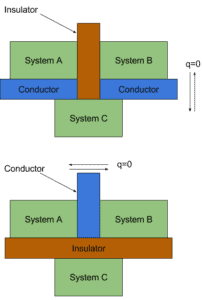
Nous pouvons découvrir une propriété importante de l’ équilibre thermique en considérant trois systèmes . A, B et C qui initialement ne sont pas en équilibre thermique . Nous séparons les systèmes A et B avec un mur adiabatique (matériau isolant idéal), mais nous laissons le système C interagir avec les deux systèmes A et B. Nous attendons que l’ équilibre thermique soit atteint; alors A et B sont chacun en équilibre thermique avec C. Mais sont-ils en équilibre thermique les uns avec les autres?
Selon de nombreuses expériences , il n’y aura pas de flux d’énergie nette entre A et B . Ceci est une preuve expérimentale de la déclaration suivante:
Si deux systèmes sont tous deux en équilibre thermique avec un troisième, ils sont en équilibre thermique l’un avec l’autre.
Cette affirmation est connue sous le nom de loi zéro de la thermodynamique . Il a ce nom inhabituel car ce n’est que jusqu’à ce que les grands et deuxièmes lois de la thermodynamique aient été élaborés que les scientifiques se sont rendus compte que ce postulat apparemment évident devait être énoncé d’abord.
 Cette loi fournit une définition et une méthode de définition de la température , peut-être la propriété intensive la plus importante d’un système face à des problèmes de conversion d’énergie thermique. La température est une propriété d’un système qui détermine si le système sera en équilibre thermique avec d’autres systèmes. Lorsque deux systèmes sont en équilibre thermique, leurs températures sont, par définition, égales, et aucune énergie thermique nette ne sera échangée entre eux. Ainsi, l’importance de la loi zéro est qu’elle permet une définition utile de la température.
Cette loi fournit une définition et une méthode de définition de la température , peut-être la propriété intensive la plus importante d’un système face à des problèmes de conversion d’énergie thermique. La température est une propriété d’un système qui détermine si le système sera en équilibre thermique avec d’autres systèmes. Lorsque deux systèmes sont en équilibre thermique, leurs températures sont, par définition, égales, et aucune énergie thermique nette ne sera échangée entre eux. Ainsi, l’importance de la loi zéro est qu’elle permet une définition utile de la température.