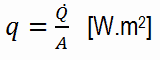Introduction au transfert de chaleur
 Alors que l’énergie interne fait référence à l’énergie totale de toutes les molécules de l’objet, la chaleur est la quantité d’énergie qui circule spontanément d’un corps à un autre en raison de leur différence de température. La chaleur est une forme d’énergie, mais c’est une énergie en transit . La chaleur n’est pas la propriété d’un système. Cependant, le transfert d’énergie sous forme de chaleur se produit au niveau moléculaire à la suite d’une différence de température .
Alors que l’énergie interne fait référence à l’énergie totale de toutes les molécules de l’objet, la chaleur est la quantité d’énergie qui circule spontanément d’un corps à un autre en raison de leur différence de température. La chaleur est une forme d’énergie, mais c’est une énergie en transit . La chaleur n’est pas la propriété d’un système. Cependant, le transfert d’énergie sous forme de chaleur se produit au niveau moléculaire à la suite d’une différence de température .
Considérons un bloc de métal à haute température, constitué d’atomes oscillant intensément autour de leurs positions moyennes. À basse température , les atomes continuent à osciller, mais avec moins d’intensité . Si un bloc de métal plus chaud est mis en contact avec un bloc plus froid, les atomes qui oscillent intensément au bord du bloc plus chaud dégagent son énergie cinétique aux atomes les moins oscillants situés au bord du bloc froid. Dans ce cas, il y a transfert d’énergie entre ces deux blocs et la chaleur circule du bloc le plus chaud au bloc le plus froid par ces vibrations aléatoires.
De même, comme pour le travail, il est important de faire la distinction entre la chaleur ajoutée à un système de son environnement et la chaleur retirée d’un système à son environnement. Q est positif pour la chaleur ajoutée au système, donc si la chaleur quitte le système, Q est négatif. Parce que W dans l’équation est le travail effectué par le système, alors si le travail est effectué sur le système, W sera négatif et E int augmentera.
Le symbole q est parfois utilisé pour indiquer la chaleur ajoutée ou retirée d’un système par unité de masse . Il est égal à la chaleur totale (Q) ajoutée ou retirée divisée par la masse (m).
Distinguer la température, la chaleur et l’énergie interne
En utilisant la théorie cinétique, une distinction claire entre ces trois propriétés peut être faite.
- La température est liée aux énergies cinétiques des molécules d’un matériau. C’est l’énergie cinétique moyenne des molécules individuelles.
- L’énergie interne fait référence à l’énergie totale de toutes les molécules à l’intérieur de l’objet. C’est une propriété étendue , donc lorsque deux lingots chauds à masse égale d’acier peuvent avoir la même température, mais deux d’entre eux ont deux fois plus d’énergie interne que l’un.
- Enfin, la chaleur est la quantité d’énergie qui circule d’un corps à l’autre spontanément en raison de leur différence de température.
Il faut l’ajouter, lorsqu’il existe une différence de température , la chaleur s’écoule spontanément du système le plus chaud vers le système le plus froid . Ainsi, si un cube d’acier de 5 kg à 100 ° C est mis en contact avec un cube d’acier de 500 kg à 20 ° C, la chaleur circule du cube à 300 ° C vers le cube à 20 ° C même si l’énergie interne du cube à 20 ° C est beaucoup plus grand car il y en a tellement plus.
Un concept particulièrement important est l’équilibre thermodynamique . En général, lorsque deux objets sont mis en contact thermique , la chaleur circule entre eux jusqu’à ce qu’ils s’équilibrent .
Densité de flux thermique – Flux thermique
Le taux de transfert de chaleur par unité de surface normale à la direction du transfert de chaleur est appelé flux de chaleur . Parfois, il est également appelé densité de flux de chaleur . En SI, ses unités sont des watts par mètre carré ( Wm −2 ). Il a à la fois une direction et une grandeur, et c’est donc une quantité vectorielle. Le flux de chaleur moyen s’exprime comme suit:
où A est la zone de transfert de chaleur. L’unité de flux de chaleur en unités anglaises est Btu / h · ft 2 . Notez que le flux de chaleur peut varier avec le temps ainsi que la position sur une surface.
Dans les réacteurs nucléaires, les limitations du flux de chaleur local sont de la plus haute importance pour la sûreté des réacteurs . Le combustible nucléaire étant constitué de barres de combustible, le flux de chaleur y est défini en unités de W / cm (densité de flux de chaleur linéaire locale) ou de kW / barre (puissance par barre de combustible).
Voir aussi: Densité de flux thermique
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci