Energie interne – Energie thermique
L’énergie potentielle et l’énergie cinétique , qui ont été discutées dans les chapitres précédents, sont des formes d’énergie macroscopiques . Ils dépendent de variables macroscopiques telles que la position et la vitesse des objets.
En thermodynamique, l’énergie interne (également appelée énergie thermique ) est définie comme l’énergie associée aux formes d’énergie microscopiques . C’est une quantité considérable , cela dépend de la taille du système ou de la quantité de substance qu’il contient. L’unité SI de l’énergie interne est le joule (J) . C’est l’énergie contenue dans le système, à l’exclusion de l’énergie cinétique de mouvement du système dans son ensemble et de l’énergie potentielle du système. Les formes d’énergie microscopiques incluent celles dues à la rotation , à la vibration, à la translation et aux interactionsparmi les molécules d’une substance. Aucune de ces formes d’énergie ne peut être mesurée ou évaluée directement, mais des techniques ont été développées pour évaluer l’évolution de la somme totale de toutes ces formes d’énergie microscopiques.
De plus, l’énergie peut être stockée dans les liaisons chimiques entre les atomes qui composent les molécules. Ce stockage d’énergie au niveau atomique inclut l’énergie associée aux états orbitaux des électrons, au spin nucléaire et aux forces de liaison dans le noyau.
L’énergie interne est représentée par le symbole U et le changement d’énergie interne dans un processus est U 2 – U 1 .
Energie microscopique
L’énergie interne implique l’énergie à l’ échelle microscopique . Il peut être divisé en énergie potentielle microscopique, en U pot et en énergie cinétique microscopique, U kin , en composants:
U = U pot + U kin
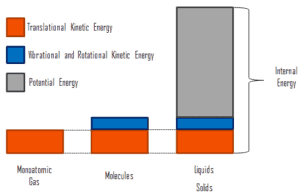 où l’énergie cinétique microscopique, U kin , implique les mouvements de toutes les particules du système par rapport au repère du centre de masse. Pour un gaz monoatomique idéal , il ne s’agit que de l’ énergie cinétique de translation du mouvement linéaire des atomes. Les particules monoatomiques ne tournent pas et ne vibrent pas. Le comportement du système est bien décrit par la théorie cinétique des gaz. La théorie cinétique repose sur le fait que lors d’une collision élastique entre une molécule à haute énergie cinétique et une autre à faible énergie cinétique, une partie de l’énergie sera transférée à la molécule à plus faible énergie cinétique. Cependant, pour les gaz polyatomiques, il existe une rotation etl’énergie cinétique vibratoire aussi.
où l’énergie cinétique microscopique, U kin , implique les mouvements de toutes les particules du système par rapport au repère du centre de masse. Pour un gaz monoatomique idéal , il ne s’agit que de l’ énergie cinétique de translation du mouvement linéaire des atomes. Les particules monoatomiques ne tournent pas et ne vibrent pas. Le comportement du système est bien décrit par la théorie cinétique des gaz. La théorie cinétique repose sur le fait que lors d’une collision élastique entre une molécule à haute énergie cinétique et une autre à faible énergie cinétique, une partie de l’énergie sera transférée à la molécule à plus faible énergie cinétique. Cependant, pour les gaz polyatomiques, il existe une rotation etl’énergie cinétique vibratoire aussi.
L’énergie potentielle microscopique, U pot , implique les liaisons chimiques entre les atomes qui constituent les molécules, les forces de liaison dans le noyau ainsi que les champs de forces physiques du système (par exemple, les champs électriques ou magnétiques).
Dans les liquides et les solides, il existe une composante importante d’énergie potentielle associée aux forces d’attraction intermoléculaires .
Énergie interne spécifique
L’ énergie interne spécifique (u) d’une substance est son énergie interne par unité de masse. C’est une propriété intensive . Elle est égale à l’énergie interne totale (U) divisée par la masse totale (m).
u = U / m
où:
u = énergie interne spécifique (J / kg)
U = énergie interne (J)
m = masse (kg)
Énergie interne d’un gaz parfait
Gaz monoatomique
Pour un gaz parfait monatomique (tel que l’hélium, le néon ou l’argon), la seule contribution à l’énergie provient de l’énergie cinétique de translation . L’énergie cinétique de translation moyenne d’un seul atome ne dépend que de la température du gaz et est donnée par l’équation
K moy = 3/2 kT.
L’ énergie interne de n moles d’un gaz monatomique idéal (un atome par molécule) est égale à l’énergie cinétique moyenne par molécule multipliée par le nombre total de molécules, N:
E int = 3/2 NkT = 3/2 nRT
où n est le nombre de moles. Chaque direction (x, y et z) contribue (1/2) nRT à l’énergie interne. C’est là qu’intervient l’idée d’équipartition d’énergie – toute autre contribution à l’énergie doit également contribuer (1/2) nRT. Comme on peut le voir, l’énergie interne d’un gaz parfait ne dépend que de la température et du nombre de moles de gaz.
Molécule diatomique
Si les molécules de gaz contiennent plus d’un atome, il existe trois directions de translation et l’énergie cinétique de rotation contribue également, mais uniquement pour les rotations autour de deux des trois axes perpendiculaires. Les cinq contributions à l’énergie (cinq degrés de liberté) donnent:
Gaz idéal diatomique:
E int = (5/2) NkT = (5/2) nRT
Ceci n’est qu’une approximation et s’applique aux températures intermédiaires. Aux basses températures, seule l’énergie cinétique de translation contribue, et à des températures plus élevées, deux contributions supplémentaires (énergie cinétique et potentielle) proviennent des vibrations.
L’énergie interne sera plus grande à une température donnée que pour un gaz monoatomique, mais elle ne restera fonction que de la température pour un gaz parfait.
L’énergie interne des gaz réels dépend également principalement de la température, mais de la même manière que la loi des gaz parfaits , l’énergie interne des gaz réels dépend également quelque peu de la pression et du volume. Tous les gaz réels approchent de l’état idéal à de faibles pressions (densités). A basse pression, les molécules sont suffisamment éloignées pour ne pas interagir les unes avec les autres. L’énergie interne des liquides et des solides est assez compliquée, car elle comprend l’énergie potentielle électrique associée aux forces (ou liaisons «chimiques») entre les atomes et les molécules.
La deuxième loi de Joule
Pour tout gaz dont l’équation d’état est donnée exactement par pV = nRT (ou pv = RT), l’ énergie interne spécifique dépend uniquement de la température. Cette règle a été initialement trouvée en 1843 par Joule expérimentalement pour les gaz réels et est connue comme le deuxième principe de Joule :
L’énergie interne d’une masse fixe d’un gaz parfait ne dépend que de sa température (et non de la pression ou du volume).
L’enthalpie spécifique d’un gaz décrite par pV = nRT dépend également uniquement de la température. Notez que l’enthalpie est la quantité thermodynamique équivalente au contenu calorifique total d’un système. Elle est égale à l’énergie interne du système plus le produit de la pression et du volume. Dans les variables intensives, la deuxième loi de Joule est donc donnée par h = h (T) = u (T) + pv = u (T) + RT .
Ces trois équations constituent le modèle de gaz parfait, résumé comme suit:
pv = RT
u = u (T)
h = h (T) = u (T) + RT
Énergie interne et première loi de la thermodynamique
En thermodynamique, le concept d’énergie est élargi pour tenir compte des autres changements observés, et le principe de conservation de l’énergie est étendu pour inclure une grande variété de façons dont les systèmes interagissent avec leur environnement. Les seules façons dont l’énergie d’un système fermé peut être modifiée sont le transfert d’énergie par le travail ou par la chaleur . De plus, sur la base des expériences de Joule et d’autres, un aspect fondamental du concept énergétique est que l’ énergie est conservée. Ce principe est connu comme le première principe de la thermodynamique . La première loi de la thermodynamique peut s’écrire sous différentes formes:
Dans les mots:
Formulaire d’équation:
∆E int = Q – W
où E int représente l’ énergie interne du matériau, qui ne dépend que de l’ état du matériau (température, pression et volume). Q est la chaleur nette ajoutée au système et W est le travail net effectué par le système. Nous devons être prudents et cohérents en suivant les conventions de signe pour Q et W. Parce que W dans l’équation est le travail effectué par le système, alors si le travail est effectué sur le système, W sera négatif et E int augmentera.
De même, Q est positif pour la chaleur ajoutée au système, donc si la chaleur quitte le système, Q est négative. Cela nous dit ce qui suit: L’ énergie interne d’un système a tendance à augmenter si la chaleur est absorbée par le système ou si un travail positif est effectué sur le système. Inversement, l’énergie interne a tendance à diminuer si la chaleur est perdue par le système ou si un travail négatif est effectué sur le système. Il faut ajouter que Q et W dépendent du chemin, tandis que E int est indépendant du chemin.
Forme différentielle:
dE int = dQ – dW
L’énergie interne E int d’un système a tendance à augmenter si de l’énergie est ajoutée sous forme de chaleur Q et a tendance à diminuer si de l’énergie est perdue en tant que travail W effectué par le système.
Voir aussi: Système ouvert – Système fermé – Système isolé
Distinguer la température, la chaleur et l’énergie interne
En utilisant la théorie cinétique, une distinction claire entre ces trois propriétés peut être faite.
- La température est liée aux énergies cinétiques des molécules d’un matériau. C’est l’énergie cinétique moyenne des molécules individuelles.
- L’énergie interne fait référence à l’énergie totale de toutes les molécules à l’intérieur de l’objet. C’est une propriété étendue , donc lorsque deux lingots chauds à masse égale d’acier peuvent avoir la même température, mais deux d’entre eux ont deux fois plus d’énergie interne que l’un.
- Enfin, la chaleur est la quantité d’énergie qui circule d’un corps à l’autre spontanément en raison de leur différence de température.
Il faut l’ajouter, lorsqu’il existe une différence de température , la chaleur s’écoule spontanément du système le plus chaud vers le système le plus froid . Ainsi, si un cube d’acier de 5 kg à 100 ° C est mis en contact avec un cube d’acier de 500 kg à 20 ° C, la chaleur circule du cube à 300 ° C vers le cube à 20 ° C même si l’énergie interne du cube à 20 ° C est beaucoup plus grand car il y en a tellement plus.
Un concept particulièrement important est l’équilibre thermodynamique . En général, lorsque deux objets sont mis en contact thermique , la chaleur circule entre eux jusqu’à ce qu’ils s’équilibrent .
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci
