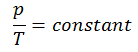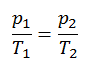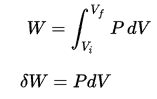Processus isochorique – Équation du gaz parfait
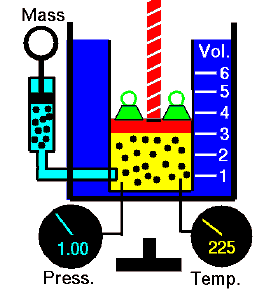
Un processus isochore est un processus thermodynamique, dans lequel le volume du système fermé reste constant (V = const). Il décrit le comportement du gaz à l’intérieur du conteneur, qui ne peut pas être déformé. Étant donné que le volume reste constant, le transfert de chaleur dans ou hors du système ne fonctionne pas avec le p∆V , mais modifie uniquement l’ énergie interne (la température) du système. Pour un gaz parfait et un processus polytropique , le cas n ➝ ∞ correspond à un processus isochore (volume constant) .
Voir aussi: Qu’est-ce qu’un gaz parfait
 Supposons un apport de chaleur isochore dans un gaz parfait. Dans un gaz parfait , les molécules n’ont pas de volume et n’interagissent pas. Selon la loi du gaz parfait , la pression varie linéairement avec la température et la quantité, et inversement avec le volume .
Supposons un apport de chaleur isochore dans un gaz parfait. Dans un gaz parfait , les molécules n’ont pas de volume et n’interagissent pas. Selon la loi du gaz parfait , la pression varie linéairement avec la température et la quantité, et inversement avec le volume .
pV = nRT
où:
- p est la pression absolue du gaz
- n est la quantité de substance
- T est la température absolue
- V est le volume
- R est la constante de gaz parfaite ou universelle, égale au produit de la constante de Boltzmann et de la constante d’Avogadro,
Dans cette équation, le symbole R est une constante appelée constante de gaz universelle qui a la même valeur pour tous les gaz, à savoir R = 8,31 J / mol K.
Le processus isochore peut s’exprimer avec la loi du gaz parfait comme:
ou
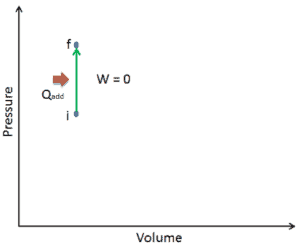
Sur un diagramme pV , le processus se produit le long d’une ligne horizontale qui a l’équation V = constante.
Le travail pression-volume par le système fermé est défini comme:
Le processus étant isochore , dV = 0 , le travail pression-volume est égal à zéro . Selon le modèle de gaz parfait, l’énergie interne peut être calculée par:
∆U = mc v ∆T
lorsque la propriété c v (J / mol K) est appelée chaleur spécifique (ou capacité calorifique ) à volume constant car, dans certaines conditions spéciales (volume constant), elle relie le changement de température d’un système à la quantité d’énergie ajoutée par transfert de chaleur.
Puisqu’il n’y a aucun travail effectué par ou sur le système, la première loi de la thermodynamique dicte ∆U = ∆Q. Donc:
Q = mc v ∆T
Voir aussi: Chaleur spécifique à volume constant et pression constante
Voir aussi: formule de Mayer

……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci