Entalpia em unidades extensivas
H = U + pV
A entalpia é uma quantidade extensa, depende do tamanho do sistema ou da quantidade de substância que ele contém. A unidade SI de entalpia é o joule (J). É a energia contida no sistema, excluindo a energia cinética do movimento do sistema como um todo e a energia potencial do sistema como um todo devido a campos de força externos. É a quantidade termodinâmica equivalente ao conteúdo total de calor de um sistema.
Por outro lado, a energia pode ser armazenada nas ligações químicas entre os átomos que compõem as moléculas. Esse armazenamento de energia no nível atômico inclui energia associada a estados orbitais de elétrons, rotação nuclear e forças de ligação no núcleo.
A entalpia é representada pelo símbolo H , e a alteração na entalpia em um processo é H 2 – H 1 .
Existem expressões em termos de variáveis mais familiares, como temperatura e pressão :
dH = C p dT + V (1-aT) dp
Onde C p é a capacidade calorífica a pressão constante e α é o coeficiente de expansão térmica (cúbico). Para o gás ideal αT = 1 e, portanto:
dH = C p dT
Exemplo: Pistão sem atrito – Calor – Entalpia

Um pistão sem atrito é usado para proporcionar uma pressão constante de 500 kPa num cilindro contendo vapor ( vapor sobreaquecido ) de um volume de 2 m 3 a 500 K . Calcule a temperatura final, se 3000 kJ de calor forem adicionados.
Solução:
Usando tabelas de vapor , sabemos que a entalpia específica desse vapor (500 kPa; 500 K) é de cerca de 2912 kJ / kg . Como nessa condição o vapor possui densidade de 2,2 kg / m 3 , sabemos que há cerca de 4,4 kg de vapor no pistão na entalpia de 2912 kJ / kg x 4,4 kg = 12812 kJ .
Quando usamos simplesmente Q = H 2 – H 1 , a entalpia resultante do vapor será:
H 2 = H 1 + Q = 15812 kJ
Nas tabelas de vapor , esse vapor superaquecido (15812 / 4,4 = 3593 kJ / kg) terá uma temperatura de 828 K (555 ° C) . Uma vez que nesta entalpia do vapor tem a densidade de 1,31 kg / m 3 , é óbvio que se expandiu em cerca de 2,2 / 1,31 = 1,67 (+ 67%). Portanto, o volume resultante é de 2 m 3 x 1,67 = 3,34 m 3 e ∆V = 3,34 m 3 – 2 m 3 = 1,34 m 3 .
A parte p∆V da entalpia, ou seja, o trabalho realizado é:
W = p∆V = 500 000 Pa x 1,34 m 3 = 670 kJ
Exemplo: Balanço Energético em um Gerador de Vapor
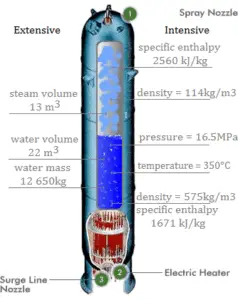
Calcule a quantidade de líquido de arrefecimento primário necessária para evaporar 1 kg de água de alimentação em um gerador de vapor típico . Suponha que não haja perdas de energia, este é apenas um exemplo idealizado.
Saldo do circuito primário
O líquido de arrefecimento primário quente ( água 330 ° C; 626 ° F; 16MPa ) é bombeado para o gerador de vapor através da entrada primária. O líquido de arrefecimento primário sai (água 295 ° C; 563 ° F; 16MPa) do gerador de vapor pela saída primária.
h I, entrada = 1516 kJ / kg
=> Δh I = -206 kJ / kg
h I, saída = 1310 kJ / kg
Equilíbrio da água de alimentação
A água de alimentação ( água 230 ° C; 446 ° F; 6,5MPa ) é bombeada para o gerador de vapor através da entrada de água de alimentação. A água de alimentação (circuito secundário) é aquecida de ~ 230 ° C 446 ° F até o ponto de ebulição desse fluido (280 ° C; 536 ° F; 6,5MPa) . A água de alimentação é então evaporada e o vapor pressurizado ( vapor saturado 280 ° C; 536 ° F; 6,5 MPa) sai do gerador de vapor através da saída de vapor e continua na turbina a vapor.
h II, entrada = 991 kJ / kg
=> Δh II = 1789 kJ / kg
h II, saída = 2780 kJ / kg
Equilíbrio do gerador de vapor
Como a diferença de entalpias específicas é menor para refrigerante primário do que para água de alimentação, é óbvio que a quantidade de refrigerante primário será maior que 1 kg. Para produzir 1 kg de vapor saturado a partir da água de alimentação, são necessários cerca de 1789/206 x 1 kg = 8,68 kg de refrigerante primário.
Exemplo: combustão de hidrogênio
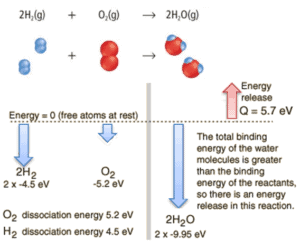
Considere a combustão de hidrogênio no ar. Em uma chama de gás hidrogênio puro, queimando no ar, o hidrogênio (H 2 ) reage com o oxigênio (O 2 ) para formar água (H 2 O) e libera energia .
Energicamente, o processo pode ser considerado para exigir a energia para dissociar o H 2 e O 2 , mas, em seguida, a ligação do inibidor da H 2 O retorna o sistema para um estado ligado com potencial negativo . Na verdade, é mais negativo do que os estados ligados dos reagentes, e a formação das duas moléculas de água é, portanto, uma reação exotérmica , que libera 5,7 eV de energia. Em palavras de entalpia, a entalpia de combustão é −286 kJ / mol:
2H 2 (g) + O 2 (g) → 2H 2 O (g)
Em palavras de entalpia, a entalpia de combustão é −286 kJ / mol (energia por mol de hidrogênio molecular):
2H 2 (g) + O 2 (g) → 2H 2 O (l) +572 kJ
O balanço de energia antes e depois da reação pode ser ilustrado esquematicamente com o estado em que todos os átomos são livres, tomados como referência de energia.
Exemplo: Entalpia de Vapor Molhado
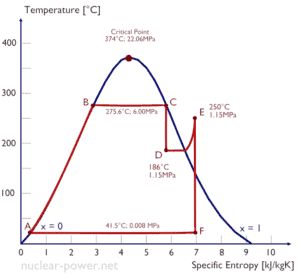
Um estágio de alta pressão da turbina a vapor opera em estado estacionário com condições de entrada de 6 MPa, t = 275,6 ° C, x = 1 (ponto C). O vapor sai deste estágio da turbina a uma pressão de 1,15 MPa, 186 ° C ex = 0,87 (ponto D). Calcule a diferença de entalpia entre esses dois estados.
A entalpia para o estado C pode ser coletada diretamente das tabelas de vapor , enquanto a entalpia para o estado D deve ser calculada usando a qualidade do vapor:
h 1, molhado = 2785 kJ / kg
h 2, molhado = h 2, s x + (1 – x) h 2, l = 2782. 0,87 + (1 – 0,87). 790 = 2420 + 103 = 2523 kJ / kg
Δh = 262 kJ / kg
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.