Entalpía en unidades extensas
H = U + pV
La entalpía es una cantidad extensa, depende del tamaño del sistema o de la cantidad de sustancia que contiene. La unidad de entalpía del SI es el joule (J). Es la energía contenida dentro del sistema, excluyendo la energía cinética de movimiento del sistema como un todo y la energía potencial del sistema como un todo debido a los campos de fuerza externos. Es la cantidad termodinámica equivalente al contenido de calor total de un sistema.
Por otro lado, la energía puede almacenarse en los enlaces químicos entre los átomos que forman las moléculas. Este almacenamiento de energía a nivel atómico incluye energía asociada con estados orbitales de electrones, espín nuclear y fuerzas de unión en el núcleo.
La entalpía está representada por el símbolo H , y el cambio en la entalpía en un proceso es H 2 – H 1 .
Hay expresiones en términos de variables más familiares como temperatura y presión :
dH = C p dT + V (1-αT) dp
Donde C p es la capacidad calorífica a presión constante y α es el coeficiente de expansión térmica (cúbica). Para gas ideal αT = 1 y por lo tanto:
dH = C p dT
Ejemplo: Pistón sin fricción – Calor – Entalpía

Un pistón sin fricción se utiliza para proporcionar una presión constante de 500 kPa en un cilindro que contiene vapor de agua ( vapor sobrecalentado ) de un volumen de 2 m 3 a 500 K . Calcule la temperatura final, si se agregan 3000 kJ de calor .
Solución:
Usando tablas de vapor , sabemos que la entalpía específica de dicho vapor (500 kPa; 500 K) es de aproximadamente 2912 kJ / kg . Como en esta condición el vapor tiene una densidad de 2.2 kg / m 3 , entonces sabemos que hay alrededor de 4.4 kg de vapor en el pistón a una entalpía de 2912 kJ / kg x 4.4 kg = 12812 kJ .
Cuando usamos simplemente Q = H 2 – H 1 , la entalpía de vapor resultante será:
H 2 = H 1 + Q = 15812 kJ
De las mesas de vapor , dicho vapor sobrecalentado (15812 / 4.4 = 3593 kJ / kg) tendrá una temperatura de 828 K (555 ° C) . Dado que en esta entalpía el vapor tiene una densidad de 1.31 kg / m 3 , es obvio que se ha expandido aproximadamente 2.2 / 1.31 = 1.67 (+ 67%). Por lo tanto, el volumen resultante es 2 m 3 x 1.67 = 3.34 m 3 y ∆V = 3.34 m 3 – 2 m 3 = 1.34 m 3 .
La parte p∆V de la entalpía, es decir, el trabajo realizado es:
W = p∆V = 500 000 Pa x 1.34 m 3 = 670 kJ
Ejemplo: Balance de energía en un generador de vapor
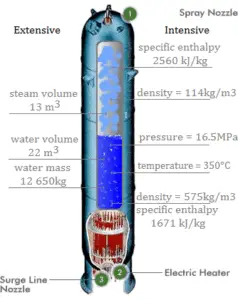
Calcule la cantidad de refrigerante primario, que se requiere para evaporar 1 kg de agua de alimentación en un generador de vapor típico . Suponga que no hay pérdidas de energía, este es solo un ejemplo idealizado.
Balance del circuito primario
El refrigerante primario caliente ( agua 330 ° C; 626 ° F; 16MPa ) se bombea al generador de vapor a través de la entrada primaria. El refrigerante primario sale (agua 295 ° C; 563 ° F; 16MPa) del generador de vapor a través de la salida primaria.
h I, entrada = 1516 kJ / kg
=> Δh I = -206 kJ / kg
h I, salida = 1310 kJ / kg
Balance del agua de alimentación
El agua de alimentación ( agua 230 ° C; 446 ° F; 6,5MPa ) se bombea al generador de vapor a través de la entrada del agua de alimentación. El agua de alimentación (circuito secundario) se calienta desde ~ 230 ° C 446 ° F hasta el punto de ebullición de ese fluido (280 ° C; 536 ° F; 6,5MPa) . El agua de alimentación se evapora y el vapor presurizado ( vapor saturado 280 ° C; 536 ° F; 6,5 MPa) sale del generador de vapor a través de la salida de vapor y continúa hacia la turbina de vapor.
h II, entrada = 991 kJ / kg
=> Δh II = 1789 kJ / kg
h II, salida = 2780 kJ / kg
Balance del generador de vapor
Dado que la diferencia en entalpías específicas es menor para el refrigerante primario que para el agua de alimentación, es obvio que la cantidad de refrigerante primario será superior a 1 kg. Para producir 1 kg de vapor saturado a partir del agua de alimentación, se requiere aproximadamente 1789/206 x 1 kg = 8,68 kg de refrigerante primario.
Ejemplo: combustión de hidrógeno
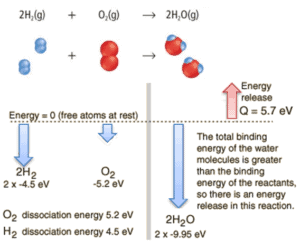
Considere la combustión de hidrógeno en el aire. En una llama de hidrógeno puro, que se quema en el aire, el hidrógeno (H 2 ) reacciona con el oxígeno (O 2 ) para formar agua (H 2 O) y libera energía .
Energéticamente, el proceso se puede considerar para requerir la energía para disociar el H 2 y O 2 , pero entonces la unión de las H 2 O devuelve el sistema a un estado ligado con potencial negativo . En realidad, es más negativo que los estados unidos de los reactivos, y la formación de las dos moléculas de agua es, por lo tanto, una reacción exotérmica , que libera 5,7 eV de energía. En palabras de entalpía, la entalpía de combustión es −286 kJ / mol:
2H 2 (g) + O 2 (g) → 2H 2 O (g)
En palabras de entalpía, la entalpía de combustión es −286 kJ / mol (energía por mol de hidrógeno molecular):
2H 2 (g) + O 2 (g) → 2H 2 O (l) +572 kJ
El equilibrio de energía antes y después de la reacción se puede ilustrar esquemáticamente con el estado en el que todos los átomos se toman libremente como referencia para la energía.
Ejemplo: entalpía de vapor húmedo
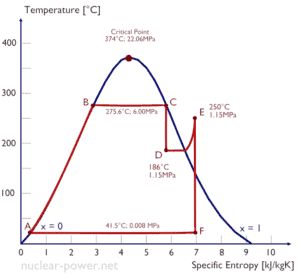
Una etapa de alta presión de la turbina de vapor funciona en estado estable con condiciones de entrada de 6 MPa, t = 275.6 ° C, x = 1 (punto C). El vapor sale de esta etapa de la turbina a una presión de 1,15 MPa, 186 ° C yx = 0,87 (punto D). Calcule la diferencia de entalpía entre estos dos estados.
La entalpía para el estado C puede seleccionarse directamente de las tablas de vapor , mientras que la entalpía para el estado D debe calcularse utilizando la calidad del vapor:
h 1, húmedo = 2785 kJ / kg
h 2, húmedo = h 2, s x + (1 – x) h 2, l = 2782. 0.87 + (1 – 0.87). 790 = 2420 + 103 = 2523 kJ / kg
Δh = 262 kJ / kg
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.