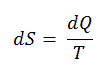O que é entropia
Na termodinâmica e na física estatística, a entropia é uma medida quantitativa de desordem ou da energia em um sistema para realizar o trabalho.Na física estatística, a entropia é uma medida do distúrbio de um sistema. A que desordem se refere é realmente o número de configurações microscópicas , W , que um sistema termodinâmico pode ter quando em um estado especificado por determinadas variáveis macroscópicas ( volume , energia , pressão e temperatura ). Por “estados microscópicos”, queremos dizer os estados exatos de todas as moléculas que compõem o sistema.
Matematicamente, a definição exata é:
Entropia = (constante k de Boltzmann) x logaritmo do número de estados possíveis
S = k B logW
Essa equação, que relaciona os detalhes microscópicos, ou microestados, do sistema (via W ) ao seu estado macroscópico (via entropia S ), é a idéia principal da mecânica estatística. Em um sistema fechado, a entropia nunca diminui; portanto, no universo, a entropia está aumentando irreversivelmente. Em um sistema aberto (por exemplo, uma árvore em crescimento), a entropia pode diminuir e a ordem pode aumentar, mas apenas à custa de um aumento na entropia em outro lugar (por exemplo, no Sol).
A entropia está aumentando.
Unidades de Entropia
O SI unidade de entropia é J / K . Segundo Clausius, a entropia foi definida através da mudança na entropia S de um sistema. A mudança na entropia S, quando uma quantidade de calor Q é adicionada a ela por um processo reversível a temperatura constante, é dada por:
Aqui Q é a energia transferida como calor para ou do sistema durante o processo, e T é a temperatura do sistema em Kelvins durante o processo. Se assumirmos um processo isotérmico reversível , a alteração total da entropia é dada por:
∆S = S 2 – S 1 = Q / T
Nesta equação, o quociente Q / T está relacionado ao aumento do distúrbio. Uma temperatura mais alta significa maior aleatoriedade de movimento. Em temperaturas mais baixas, a adição de calor Q causa um aumento fracionário substancial no movimento molecular e na aleatoriedade. Por outro lado, se a substância já estiver quente, a mesma quantidade de calor Q adiciona relativamente pouco ao maior movimento molecular.
Exemplo: alteração de entropia no gelo derretido
Calcule a variação na entropia de 1 kg de gelo a 0 ° C, quando derretida reversivelmente em água a 0 ° C.
Por se tratar de um processo isotérmico, podemos usar:
∆S = S 2 – S 1 = Q / T
portanto, a alteração da entropia será:
∆S = 334 [kJ] / 273,15 [K] = 1,22 [kJ / K]
onde são necessários 334 quilojoules de calor para derreter 1 kg de gelo (calor latente de fusão = 334 kJ / kg) e esse calor é transferido para o sistema a 0 ° C (273,15 K).
Entropia específica
A entropia pode ser transformada em uma variável intensiva ou específica dividindo-se pela massa. Os engenheiros usam mais a entropia específica na análise termodinâmica do que a própria entropia. A entropia específica de uma substância é a sua entropia por unidade de massa. É igual à entropia total (S) dividida pela massa total (m).
s = S / m
Onde:
s = entropia específica (J / kg)
S = entropia (J)
m = massa (kg)
A entropia quantifica a energia de uma substância que não está mais disponível para realizar um trabalho útil. Como a entropia diz muito sobre a utilidade de uma quantidade de calor transferida na execução do trabalho, as tabelas de vapor incluem valores de entropia específica (s = S / m) como parte das informações tabuladas.
Em geral, a entropia específica é uma propriedade de uma substância, como pressão, temperatura e volume, mas não pode ser medida diretamente. Normalmente, a entropia de uma substância é dada com relação a algum valor de referência. Por exemplo, a entropia específica de água ou vapor é dada usando a referência de que a entropia específica da água é zero a 0,01 ° C e pressão atmosférica normal , onde s = 0,00 kJ / kg. O fato de o valor absoluto da entropia específica ser desconhecido não é um problema, no entanto, porque é a mudança na entropia específica (∆s) e não o valor absoluto que é importante nos problemas práticos.
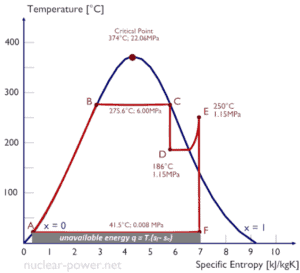
Diagramas de entropia de temperatura – Diagramas Ts
Em geral, as fases de uma substância e os relacionamentos entre suas propriedades são mais comumente mostrados nos diagramas de propriedades . Um grande número de propriedades diferentes foi definido e existem algumas dependências entre as propriedades.
Um diagrama de entropia de temperatura ( diagrama Ts ) é o tipo de diagrama mais frequentemente usado para analisar os ciclos do sistema de transferência de energia. É usado na termodinâmica para visualizar alterações de temperatura e entropia específica durante um processo ou ciclo termodinâmico.
Isso ocorre porque o trabalho realizado pelo ou no sistema e o calor adicionado ou removido do sistema podem ser visualizados no diagrama Ts . Pela definição de entropia, o calor transferido para ou de um sistema é igual à área sob a curva Ts do processo.
dQ = TdS
Um processo isentrópico é representado como uma linha vertical em um diagrama Ts, enquanto um processo isotérmico é uma linha horizontal. Em um estado idealizado, a compressão é uma bomba, a compressão em um compressor e a expansão em uma turbina são processos isentrópicos. Portanto, é muito útil em engenharia de energia, porque esses dispositivos são usados em ciclos termodinâmicos de usinas de energia.
Observe que, as premissas isentrópicas são aplicáveis apenas aos ciclos ideais. Ciclos termodinâmicos reais têm perdas de energia inerentes devido à ineficiência de compressores e turbinas.
Irreversibilidade dos processos naturais
De acordo com a segunda lei da termodinâmica:
A entropia de qualquer sistema isolado nunca diminui. Em um processo termodinâmico natural, a soma das entropias dos sistemas termodinâmicos em interação aumenta.
Esta lei indica a irreversibilidade dos processos naturais . Processos reversíveis são uma ficção teórica útil e conveniente, mas não ocorrem na natureza. A partir desta lei, é impossível construir um dispositivo que opere em um ciclo e cujo único efeito seja a transferência de calor de um corpo mais frio para um corpo mais quente. Daqui resulta que máquinas perpétuas de movimento do segundo tipo são impossíveis.
Entropia no Absoluto Zero
De acordo com a terceira lei da termodinâmica:
A entropia de um sistema se aproxima de um valor constante, à medida que a temperatura se aproxima do zero absoluto.
Com base em evidências empíricas, essa lei afirma que a entropia de uma substância cristalina pura é zero no zero absoluto da temperatura , 0 K e que é impossível por meio de qualquer processo, não importa o ideal, reduzir a temperatura de um sistema para zero absoluto em um número finito de etapas. Isso nos permite definir um ponto zero para a energia térmica de um corpo.
O zero absoluto é a temperatura teórica mais fria, na qual o movimento térmico de átomos e moléculas atinge seu mínimo. Este é um estado no qual a entalpia e a entropia de um gás ideal resfriado atingem seu valor mínimo, tomado como 0. Classicamente , esse seria um estado de imobilidade , mas a incerteza quântica determina que as partículas ainda possuem uma energia finita de ponto zero . O zero absoluto é indicado como 0 K na escala Kelvin, -273,15 ° C na escala Celsius e -459,67 ° F na escala Fahrenheit.
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.