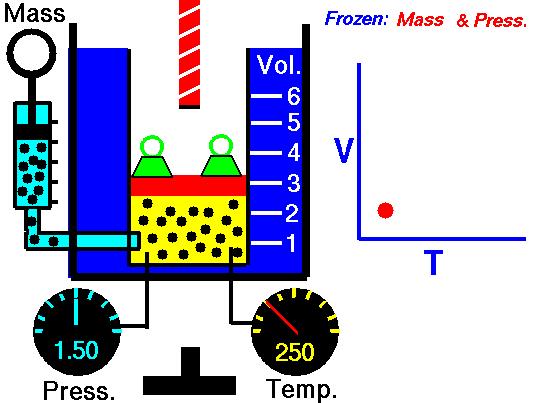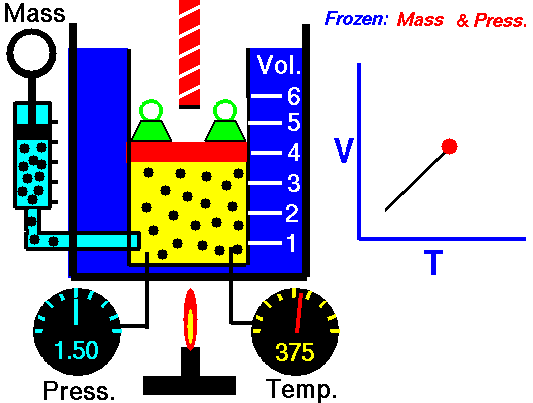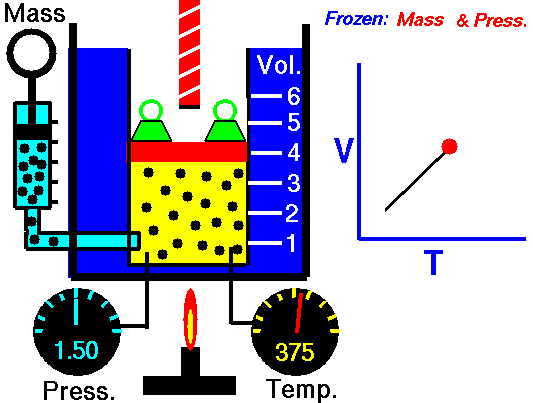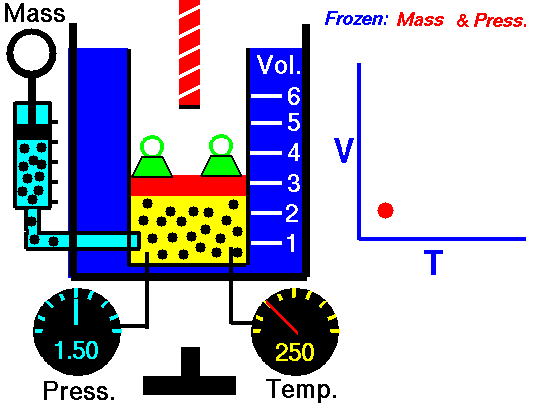
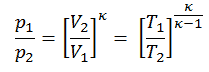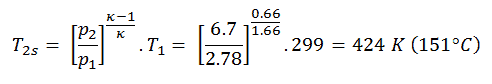Exemplo de processo isobárico – adição de calor isobárico

Vamos supor o ciclo de Brayton ideal que descreve o funcionamento de uma máquina de calor de pressão constante . Os motores modernos de turbina a gás e os motores a jato de respiração respiratória também seguem o ciclo de Brayton.
O ciclo de Brayton ideal consiste em quatro processos termodinâmicos. Dois processos isentrópicos e dois processos isobáricos.
- compressão isentrópica – o ar ambiente é aspirado para o compressor, onde é pressurizado (1 → 2). O trabalho necessário para o compressor é dado por W C = H 2 – H 1 .
- adição de calor isobárico – o ar comprimido então passa por uma câmara de combustão, onde o combustível é queimado e o ar ou outro meio é aquecido (2 → 3). É um processo de pressão constante, uma vez que a câmara está aberta para entrar e sair. O calor líquido adicionado é dado por Q add = H 3 – H 2
- expansão isentrópica – o ar aquecido e pressurizado então se expande na turbina, desistindo de sua energia. O trabalho realizado pela turbina é dado por W T = H 4 – H 3
- rejeição de calor isobárico – o calor residual deve ser rejeitado para fechar o ciclo. O calor líquido rejeitado é dado por Q re = H 4 – H 1
Suponha uma adição de calor isobárica (2 → 3) em um trocador de calor. Em turbinas a gás típicas, o estágio de alta pressão recebe gás (ponto 3 na figura; p 3 = 6,7 MPa ; T 3 = 1190 K (917 ° C)) de um trocador de calor. Além disso, sabemos que o compressor recebe gás (ponto 1 na figura; p 1 = 2,78 MPa ; T 1 = 299 K (26 ° C)) e sabemos que a eficiência isentrópica do compressor é η K = 0,87 (87 %) .
Calcule o calor adicionado pelo trocador de calor (entre 2 → 3).
Solução:
Pela primeira lei da termodinâmica , o calor líquido adicionado é dado por Q add = H 3 – H 2 ou Q add = C p . (T 3 -T 2s ), mas neste caso não sabemos a temperatura (T 2s ) na saída do compressor. Vamos resolver esse problema em variáveis intensivas. Temos que reescrever a equação anterior (para incluir η K ) usando o termo (+ h 1 – h 1 ) para:
Q add = h 3 – h 2 = h 3 – h 1 – (h 2s – h 1 ) / η K
Q add = c p (T 3 -T 1 ) – (c p (T 2s -T 1 ) / η K )
Em seguida, calcularemos a temperatura, T 2s , usando p, V, Relação T para o processo adiabático entre (1 → 2).
Nesta equação, o fator para hélio é igual a = c p / c v = 1,66 . Da equação anterior segue que a temperatura de saída do compressor, T2s , é:
Da Lei do Gás Ideal , sabemos que o calor específico molar de um gás monoatômico ideal é:
C v = 3 / 2R = 12,5 J / mol K e C p = C v + R = 5 / 2R = 20,8 J / mol K
Transferimos as capacidades de calor específicas em unidades de J / kg K via:
c p = C p . 1 / M (peso molar de hélio) = 20,8 x 4,10 -3 = 5200 J / kg K
Usando esta temperatura e a eficiência do compressor isentrópico , podemos calcular o calor adicionado pelo trocador de calor:
Q add = c p (T 3 -T 1 ) – (c p (T 2s -T 1 ) / η K ) = 5200. (1190 – 299) – 5200. (424-299) / 0,87 = 4,633 MJ / kg – 0,747 MJ / kg = 3,886 MJ / kg