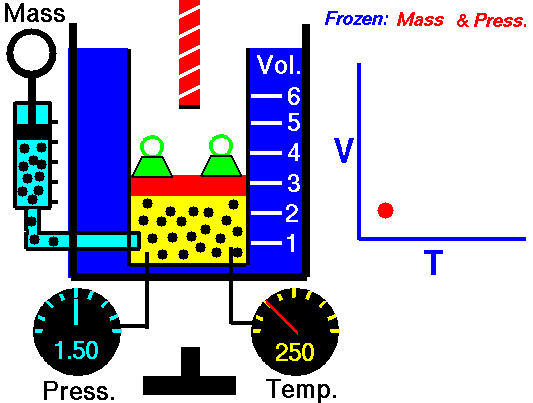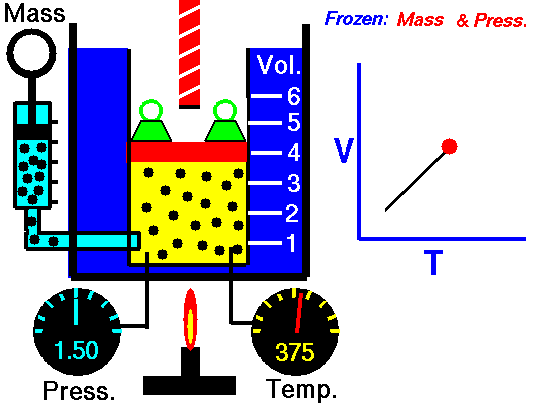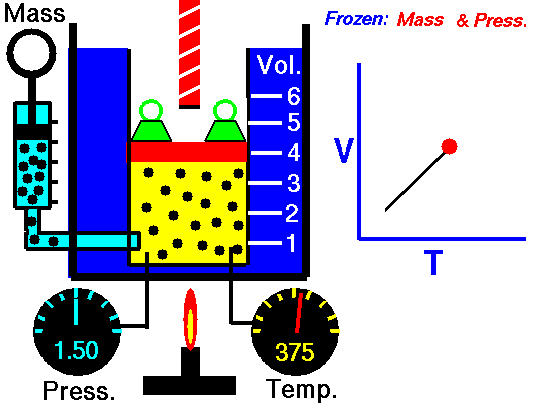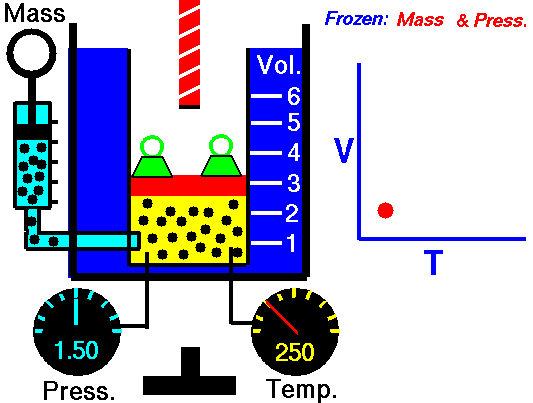
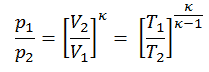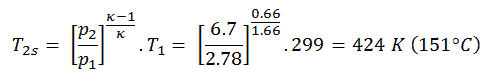Exemple de processus isobare – Addition de chaleur isobare

Supposons le cycle de Brayton idéal qui décrit le fonctionnement d’un moteur thermique à pression constante . Les moteurs à turbine à gaz modernes et les moteurs à réaction à respiration aérienne suivent également le cycle de Brayton.
Le cycle de Brayton idéal se compose de quatre processus thermodynamiques. Deux processus isentropiques et deux processus isobares.
- compression isentropique – l’air ambiant est aspiré dans le compresseur, où il est mis sous pression (1 → 2). Le travail requis pour le compresseur est donné par W C = H 2 – H 1 .
- addition de chaleur isobare – l’air comprimé traverse ensuite une chambre de combustion, où le carburant est brûlé et l’air ou un autre milieu est chauffé (2 → 3). Il s’agit d’un processus à pression constante, car la chambre est ouverte pour entrer et sortir. La chaleur nette ajoutée est donnée par Q add = H 3 – H 2
- expansion isentropique – l’air chauffé sous pression se détend ensuite sur la turbine, cède son énergie. Le travail effectué par turbine est donné par W T = H 4 – H 3
- rejet de chaleur isobare – la chaleur résiduelle doit être rejetée afin de fermer le cycle. La chaleur nette rejetée est donnée par Q re = H 4 – H 1
Supposons un apport de chaleur isobare (2 → 3) dans un échangeur de chaleur. Dans les turbines à gaz typiques, l’étage haute pression reçoit du gaz (point 3 sur la figure; p 3 = 6,7 MPa ; T 3 = 1190 K (917 ° C)) d’un échangeur de chaleur. De plus, nous savons que le compresseur reçoit du gaz (point 1 sur la figure; p 1 = 2,78 MPa ; T 1 = 299 K (26 ° C)) et nous savons que l’efficacité isentropique du compresseur est η K = 0,87 (87 %) .
Calculez la chaleur ajoutée par l’échangeur de chaleur (entre 2 → 3).
Solution:
D’après la première loi de la thermodynamique , la chaleur nette ajoutée est donnée par Q add = H 3 – H 2 ou Q add = C p . (T 3 -T 2s ), mais dans ce cas, nous ne connaissons pas la température (T 2s ) à la sortie du compresseur. Nous allons résoudre ce problème en variables intensives. Nous devons réécrire l’équation précédente (pour inclure η K ) en utilisant le terme (+ h 1 – h 1 ) pour:
Q add = h 3 – h 2 = h 3 – h 1 – (h 2s – h 1 ) / η K
Q add = c p (T 3 -T 1 ) – (c p (T 2s -T 1 ) / η K )
Ensuite, nous calculerons la température, T 2s , en utilisant la relation p, V, T pour le processus adiabatique entre (1 → 2).
Dans cette équation, le facteur pour l’hélium est égal à = c p / c v = 1,66 . D’après l’équation précédente, la température de sortie du compresseur, T 2s , est:
D’après la loi des gaz parfaits, nous savons que la chaleur spécifique molaire d’un gaz parfait monoatomique est:
C v = 3 / 2R = 12,5 J / mol K et C p = C v + R = 5 / 2R = 20,8 J / mol K
Nous transférons les capacités calorifiques spécifiques en unités de J / kg K via:
c p = C p . 1 / M (poids molaire de l’hélium) = 20,8 x 4,10 -3 = 5200 J / kg K
En utilisant cette température et l’ efficacité du compresseur isentropique, nous pouvons calculer la chaleur ajoutée par l’échangeur de chaleur:
Q add = c p (T 3 -T 1 ) – (c p (T 2s -T 1 ) / η K ) = 5200. (1190 – 299) – 5200. (424-299) /0,87 = 4,633 MJ / kg – 0,747 MJ / kg = 3,886 MJ / kg

……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci