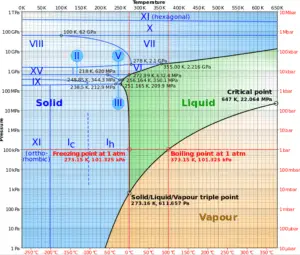
Kritischer Punkt des Wassers
In der Thermodynamik ist ein kritischer Punkt (oder kritischer Zustand ) der Endpunkt einer Phasengleichgewichtskurve. Das Phasendiagramm von Wasser ist ein Druck-Temperatur – Diagramm für Wasser , das zeigt , wie alle drei Phasen (fest, flüssig oder dampfförmig) können koexistieren im thermischen Gleichgewicht miteinander. Entlang der Verdampfungslinie befinden sich die flüssige und die dampfförmige Phase im Gleichgewicht, entlang der Fusionslinie befinden sich die feste und die flüssige Phase im Gleichgewicht und entlang der Sublimationslinie befinden sich die feste und die Dampfphase im Gleichgewicht. Der einzige Punkt, an dem alle drei Phasen im Gleichgewicht existieren können, ist der Tripelpunkt . Die Verdampfungsleitung endet am kritischen Punktweil es oberhalb des kritischen Punktes keinen deutlichen Wechsel von der flüssigen Phase zur Dampfphase gibt .
Oberhalb des kritischen Punktes findet kein Verdampfungsprozess mit konstanter Temperatur statt . Am kritischen Punkt sind der Zustand der gesättigten Flüssigkeit und des gesättigten Dampfes identisch . Die Temperatur, der Druck und das spezifische Volumen am kritischen Punkt werden als kritische Temperatur, kritischer Druck und kritisches Volumen bezeichnet. Für Wasser sind diese Parameter die folgenden:
- P cr = 22,09 MPa
- T cr = 374,14 ° C (oder 647,3 K)
- v cr = 0,003155 m³ / kg
- U f = U g = 2014 kJ / kg
- h f = h g = 2084 kJ / kg
- s f = s g = 4,406 kJ / kg K.
Eine überkritische Phase (z. B. Wasser mit einem Druck über dem kritischen Druck) trennt sich nicht in zwei Phasen, wenn es auf konstanten Druck abgekühlt wird (entlang einer horizontalen Linie über dem kritischen Punkt im Phasendiagramm). Stattdessen ändern sich seine Eigenschaften allmählich und kontinuierlich von denen, die wir normalerweise mit einem Gas assoziieren (niedrige Dichte, große Kompressibilität), zu denen einer Flüssigkeit (hohe Dichte, kleine Kompressibilität) ohne Phasenänderung.
Wie aus den Dampftabellen ersichtlich ist , werden die Unterschiede in den physikalischen Eigenschaften (wie Dichte und Enthalpie) zwischen der Flüssigkeits- und der Dampfphase kleiner , wenn wir uns dem kritischen Punkt nähern . Beispielsweise beträgt die spezifische Enthalpie der gesättigten Flüssigkeit knapp unterhalb des kritischen Punktes bei einem Druck von 21,8 MPa und einer Temperatur von 373 ° C 1970 kJ / kg, während die spezifische Enthalpie des gesättigten Dampfes 2230 kJ / kg beträgt. Die spezifische Verdampfungswärme beträgt nur 260 kJ / kg. Genau am kritischen Punkt werden diese Unterschiede Null, und an diesem Punkt verschwindet die Unterscheidung zwischen Flüssigkeit und Dampf. Die Verdampfungswärme wird am kritischen Punkt ebenfalls Null .
Nahe dem kritischen Punkt ändern sich die physikalischen Eigenschaften der Flüssigkeit und des Dampfes dramatisch. Beispielsweise hat flüssiges Wasser unter normalen Bedingungen einen niedrigen Wärmeausdehnungskoeffizienten, ist nahezu inkompressibel, ist ein ausgezeichnetes Lösungsmittel für Elektrolyte und hat eine hohe Dielektrizitätskonstante. In der Nähe des kritischen Punktes ändern sich alle diese Eigenschaften in genau das Gegenteil: Wasser wird komprimierbar, hat einen signifikanten Wärmeausdehnungskoeffizienten, eine niedrige Dielektrizitätskonstante und ist ein schlechtes Lösungsmittel für Elektrolyte. Bei Drücken, die größer als der kritische Druck sind, gehen die physikalischen Eigenschaften ebenfalls schnell über, jedoch ohne Singularitäten. Mit weiterem Druckanstieg wird der Übergang glatter. Dieser Übergangsbereich wird als pseudokritischer Bereich bezeichnetBei einem gegebenen Druck wird die Temperatur, bei der die spezifische Wärme ihr Maximum hat, als pseudokritischer Punkt bezeichnet.
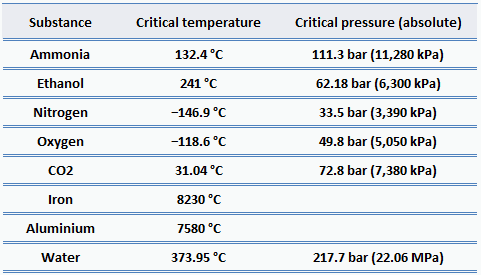
Bei fast allen bekannten Materialien sind die kritischen Drücke viel höher als der atmosphärische Druck, daher beobachten wir dieses Verhalten im Alltag nicht. In der Energietechnik gibt es jedoch viele Anwendungen für überkritisches Wasser . Eine Möglichkeit zur Erhöhung des thermischen Wirkungsgrads von thermodynamischen Kreisprozessen (z. B. Rankine-Zyklus) besteht darin, die Spitzentemperatur und den Spitzendruck im Kessel zu erhöhen. Hochdruckdampfkessel in Wärmekraftwerken laufen regelmäßig bei Drücken und Temperaturen weit über dem kritischen Punkt.
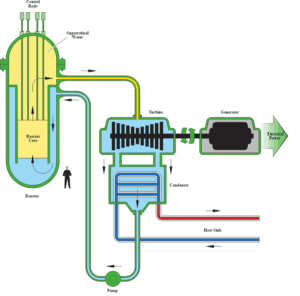
Autor (gemeinfrei): US-Energieministerium
In der Nukleartechnik gilt der überkritische Wasserreaktor aufgrund seines hohen thermischen Wirkungsgrads als vielversprechender Fortschritt für Kernkraftwerke (~ 45% gegenüber ~ 33% bei aktuellen LWR). Dieses Reaktorkonzept arbeitet bei überkritischem Druck (dh mehr als 22,1 MPa) und gehört zu den Reaktorkonstruktionen der Generation IV .
Siehe auch: Überkritischer Wasserreaktor
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.