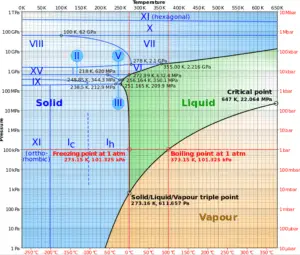
Ponto Crítico da Água
Na termodinâmica, um ponto crítico (ou estado crítico ) é o ponto final de uma curva de equilíbrio de fase. O diagrama de fases da água é um diagrama de pressão-temperatura da água que mostra como as três fases (sólida, líquida e vapor) podem coexistir juntas em equilíbrio térmico. Ao longo da linha de vaporização, as fases líquida e de vapor estão em equilíbrio, ao longo da linha de fusão, as fases sólida e líquida estão em equilíbrio e, ao longo da linha de sublimação , as fases sólida e de vapor estão em equilíbrio. O único ponto no qual todas as três fases podem existir em equilíbrio é o ponto triplo . A linha de vaporização termina no ponto críticoporque não há mudança distinta da fase líquida para a fase vapor acima do ponto crítico .
Acima do ponto crítico , não há processo de vaporização a temperatura constante . No ponto crítico, os estados líquido saturado e vapor saturado são idênticos . A temperatura, pressão e volume específico no ponto crítico são chamados temperatura crítica, pressão crítica e volume crítico. Para a água, esses parâmetros são os seguintes:
- P cr = 22,09 MPa
- T cr = 374,14 ° C (ou 647,3 K)
- v cr = 0,003155 m3 / kg
- u f = u g = 2014 kJ / kg
- h f = h g = 2084 kJ / kg
- s f = s g = 4,406 kJ / kg K
Uma fase supercrítica (por exemplo, água a uma pressão acima da pressão crítica) não se separa em duas fases quando é resfriada a pressão constante (ao longo de uma linha horizontal acima do ponto crítico no diagrama de fases). Em vez disso, suas propriedades mudam gradual e continuamente daquelas que normalmente associamos a um gás (baixa densidade, grande compressibilidade) para as de um líquido (alta densidade, pequena compressibilidade) sem uma mudança de fase.
Como pode ser visto nas tabelas de vapor , quando nos aproximamos do ponto crítico , as diferenças nas propriedades físicas (como densidade e entalpia) entre as fases líquida e de vapor se tornam menores . Por exemplo, logo abaixo do ponto crítico à pressão de 21,8 MPa e à temperatura de 373 ° C, a entalpia específica do líquido saturado é de 1970 kJ / kg, enquanto a entalpia específica do vapor saturado é de 2230 kJ / kg. O calor específico da vaporização é de apenas 260 kJ / kg. Exatamente no ponto crítico, essas diferenças se tornam nulas e, nesse ponto, a distinção entre líquido e vapor desaparece. O calor da vaporização também se torna zero no ponto crítico .
Perto do ponto crítico, as propriedades físicas do líquido e do vapor mudam dramaticamente. Por exemplo, a água líquida em condições normais tem um baixo coeficiente de expansão térmica, é quase incompressível, é um excelente solvente para eletrólitos e possui uma constante dielétrica alta. Mas perto do ponto crítico, todas essas propriedades mudam exatamente para o oposto: a água se torna compressível, tem um coeficiente de expansão térmica significativo, tem uma constante dielétrica baixa, é um solvente ruim para os eletrólitos. A pressões superiores à pressão crítica, as propriedades físicas também passam por uma transição rápida, mas sem singularidades. Com o aumento da pressão, a transição se torna mais suave. Essa região de transição é chamada região pseudocrítica, a uma dada pressão, a temperatura em que o calor específico tem seu máximo é chamada de ponto pseudocrítico.
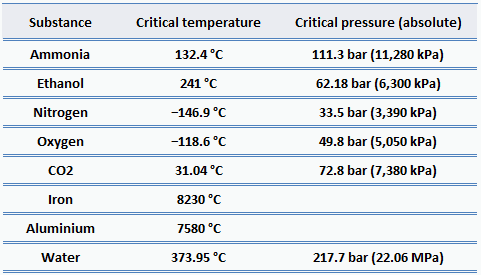
Para quase todos os materiais familiares, as pressões críticas são muito maiores que a pressão atmosférica; portanto, não observamos esse comportamento na vida cotidiana. Mas na engenharia de energia , existem muitas aplicações para água supercrítica . Uma das maneiras de aumentar a eficiência térmica dos ciclos termodinâmicos (por exemplo, ciclo Rankine) é aumentar o pico de temperatura e pressão na caldeira. Caldeiras a vapor de alta pressão em usinas termelétricas operam regularmente a pressões e temperaturas bem acima do ponto crítico.
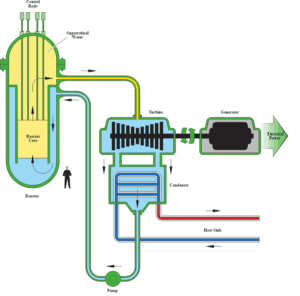
Autor (Domínio público): Departamento de Energia dos EUA
Na engenharia nuclear , o reator supercrítico de água é considerado um avanço promissor para as usinas nucleares devido à sua alta eficiência térmica (~ 45% vs. ~ 33% para as LWRs atuais). Esse conceito de reator opera a pressão supercrítica (ou seja, maior que 22,1 MPa) e pertence aos projetos de reatores da geração IV .
Veja também: Reator de água supercrítico
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.