Punto crítico de agua
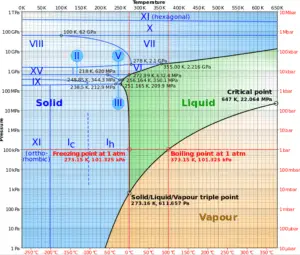
En termodinámica, un punto crítico (o estado crítico ) es el punto final de una curva de equilibrio de fase. El diagrama de fases del agua es un diagrama de presión-temperatura para el agua que muestra cómo las tres fases (sólido, líquido y vapor) pueden coexistir juntas en equilibrio térmico. A lo largo de la línea de vaporización, las fases líquida y de vapor están en equilibrio, a lo largo de la línea de fusión, las fases sólida y líquida están en equilibrio y a lo largo de la línea de sublimación , las fases sólida y de vapor están en equilibrio. El único punto en el que las tres fases pueden existir en equilibrio es el punto triple . La línea de vaporización termina en el punto crítico.porque no hay cambio distinto de la fase líquida a la fase vapor por encima del punto crítico .
Por encima del punto crítico , no existe un proceso de vaporización a temperatura constante . En el punto crítico, los estados de líquido saturado y vapor saturado son idénticos . La temperatura, la presión y el volumen específico en el punto crítico se denominan temperatura crítica, presión crítica y volumen crítico. Para el agua, estos parámetros son los siguientes:
- P cr = 22.09 MPa
- T cr = 374.14 ° C (o 647.3 K)
- v cr = 0.003155 m3 / kg
- u f = u g = 2014 kJ / kg
- h f = h g = 2084 kJ / kg
- s f = s g = 4.406 kJ / kg K
Una fase supercrítica (por ejemplo, agua a una presión superior a la presión crítica) no se separa en dos fases cuando se enfría a presión constante (a lo largo de una línea horizontal sobre el punto crítico en el diagrama de fase). En cambio, sus propiedades cambian de forma gradual y continua de las que normalmente asociamos con un gas (baja densidad, gran compresibilidad) a las de un líquido (alta densidad, pequeña compresibilidad) sin un cambio de fase.
Como se puede ver en las tablas de vapor , a medida que nos acercamos al punto crítico , las diferencias en las propiedades físicas (como la densidad y la entalpía) entre las fases líquida y de vapor se reducen . Por ejemplo, justo debajo del punto crítico a la presión de 21.8 MPa y la temperatura de 373 ° C, la entalpía específica de líquido saturado es 1970 kJ / kg, mientras que la entalpía específica de vapor saturado es 2230 kJ / kg. El calor específico de vaporización es de solo 260 kJ / kg. Exactamente en el punto crítico, estas diferencias se vuelven cero, y en este punto la distinción entre líquido y vapor desaparece. El calor de vaporización también se vuelve cero en el punto crítico .
Cerca del punto crítico, las propiedades físicas del líquido y el vapor cambian dramáticamente. Por ejemplo, el agua líquida en condiciones normales tiene un bajo coeficiente de expansión térmica, es casi incompresible, es un excelente solvente para electrolitos y tiene una alta constante dieléctrica. Pero cerca del punto crítico, todas estas propiedades cambian a exactamente lo contrario: el agua se vuelve compresible, tiene un coeficiente de expansión térmica significativo, tiene una constante dieléctrica baja, es un mal disolvente para los electrolitos. A presiones superiores a la presión crítica, las propiedades físicas también experimentan una transición rápida, pero sin singularidades. Con un aumento adicional de la presión, la transición se vuelve más suave. Esta región de transición se llama región pseudocrítica, a una presión dada, la temperatura donde el calor específico tiene su máximo se llama punto pseudocrítico.
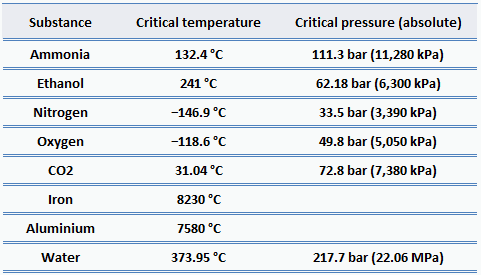
Para casi todos los materiales familiares, las presiones críticas son mucho mayores que la presión atmosférica, por lo tanto, no observamos este comportamiento en la vida cotidiana. Pero en ingeniería energética , existen muchas aplicaciones para el agua supercrítica . Una de las formas de aumentar la eficiencia térmica de los ciclos termodinámicos (por ejemplo, el ciclo de Rankine) es aumentar la temperatura y la presión pico en la caldera. Las calderas de vapor de alta presión en centrales térmicas funcionan regularmente a presiones y temperaturas muy superiores al punto crítico.
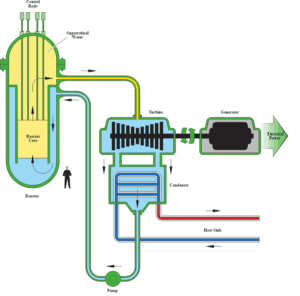
Autor (dominio público): Departamento de Energía de EE. UU.
En ingeniería nuclear , el reactor de agua supercrítico se considera un avance prometedor para las centrales nucleares debido a su alta eficiencia térmica (~ 45% frente a ~ 33% para los LWR actuales). Este concepto de reactor funciona a presión supercrítica (es decir, superior a 22,1 MPa) y pertenece a los diseños de reactores de Generación IV .
Ver también: Reactor de agua supercrítico
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.