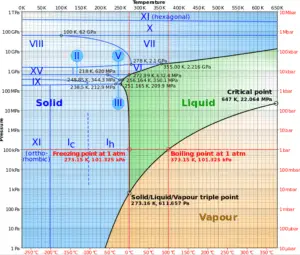
Point critique de l’eau
En thermodynamique, un point critique (ou état critique ) est le point final d’une courbe d’équilibre de phase. Le diagramme de phase de l’eau est un diagramme pression-température pour l’eau qui montre comment les trois phases (solide, liquide et vapeur) peuvent coexister ensemble en équilibre thermique. Le long de la ligne de vaporisation, les phases liquide et vapeur sont en équilibre, le long de la ligne de fusion, les phases solide et liquide sont en équilibre et le long de la ligne de sublimation , les phases solide et vapeur sont en équilibre. Le seul point où les trois phases peuvent exister en équilibre est le triple point . La ligne de vaporisation se termine au point critiqueparce qu’il n’y a pas de changement distinct de la phase liquide à la phase vapeur au-dessus du point critique .
Au-dessus du point critique , il n’y a pas de processus de vaporisation à température constante . Au point critique, les états liquide saturé et vapeur saturée sont identiques . La température, la pression et le volume spécifique au point critique sont appelés température critique, pression critique et volume critique. Pour l’eau, ces paramètres sont les suivants:
- P cr = 22,09 MPa
- T cr = 374,14 ° C (ou 647,3 K)
- v cr = 0,003155 m3 / kg
- u f = u g = 2014 kJ / kg
- h f = h g = 2084 kJ / kg
- s f = s g = 4,406 kJ / kg K
Une phase supercritique (par exemple de l’eau à une pression supérieure à la pression critique) ne se sépare pas en deux phases lorsqu’elle est refroidie à pression constante (le long d’une ligne horizontale au-dessus du point critique dans le diagramme de phase). Au lieu de cela, ses propriétés changent progressivement et en continu de celles que nous associons habituellement à un gaz (faible densité, grande compressibilité) à celles d’un liquide (haute densité, petite compressibilité) sans changement de phase.
Comme on peut le voir sur les tables de vapeur , à l’approche du point critique , les différences de propriétés physiques (telles que la densité et l’enthalpie) entre les phases liquide et vapeur deviennent plus petites . Par exemple, juste en dessous du point critique à la pression de 21,8 MPa et à la température de 373 ° C, l’enthalpie spécifique du liquide saturé est de 1970 kJ / kg, tandis que l’enthalpie spécifique de la vapeur saturée est de 2230 kJ / kg. La chaleur de vaporisation spécifique n’est que de 260 kJ / kg. Exactement au point critique, ces différences deviennent nulles et à ce stade, la distinction entre liquide et vapeur disparaît. La chaleur de vaporisation devient également nulle au point critique .
Près du point critique, les propriétés physiques du liquide et de la vapeur changent considérablement. Par exemple, l’eau liquide dans des conditions normales a un faible coefficient de dilatation thermique, est presque incompressible, est un excellent solvant pour les électrolytes et a une constante diélectrique élevée. Mais près du point critique, toutes ces propriétés se transforment en l’exact opposé: l’eau devient compressible, a un coefficient de dilatation thermique important, a une faible constante diélectrique, est un mauvais solvant pour les électrolytes. A des pressions supérieures à la pression critique, les propriétés physiques subissent également une transition rapide, mais sans singularités. Avec une nouvelle augmentation de la pression, la transition devient plus douce. Cette région de transition est appelée région pseudocrite, à une pression donnée, la température où la chaleur spécifique a son maximum est appelée point pseudo-critique.
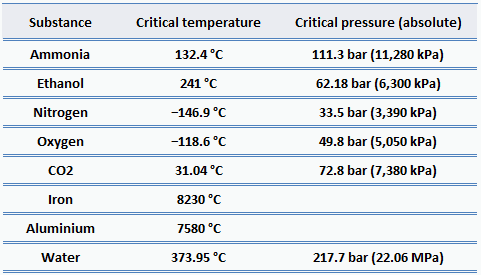
Pour presque tous les matériaux familiers, les pressions critiques sont bien supérieures à la pression atmosphérique, nous n’observons donc pas ce comportement au quotidien. Mais en génie énergétique , il existe de nombreuses applications pour l’eau supercritique . Une des façons d’augmenter l’efficacité thermique des cycles thermodynamiques (par exemple le cycle de Rankine) consiste à augmenter la température et la pression maximales dans la chaudière. Les chaudières à vapeur haute pression des centrales thermiques fonctionnent régulièrement à des pressions et des températures bien supérieures au point critique.
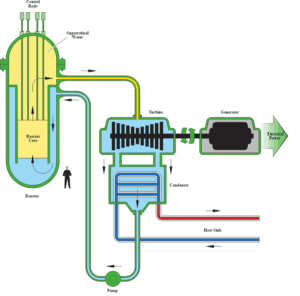
Auteur (domaine public): US Department of Energy
En génie nucléaire , le réacteur à eau supercritique est considéré comme une avancée prometteuse pour les centrales nucléaires en raison de son rendement thermique élevé (~ 45% contre ~ 33% pour les réacteurs à eau chaude actuels). Ce concept de réacteur fonctionne à une pression supercritique (c’est-à-dire supérieure à 22,1 MPa) et appartient aux conceptions de réacteurs de génération IV .
Voir aussi: Réacteur à eau supercritique
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci