 Para la condensación, los efectos de calor latente asociados con el cambio de fase son significativos, de manera similar a la ebullición, pero a la inversa. Tenga en cuenta que la entalpía de condensación (o calor de condensación ) es, por definición, igual a la entalpía de vaporización con el signo opuesto. El calor latente es la cantidad de calor agregado o eliminado de una sustancia para producir un cambio de fase. Durante la vaporización, esta energía descompone las fuerzas de atracción intermoleculares, y también debe proporcionar la energía necesaria para expandir el gas (el trabajo pΔV ). Cuando se agrega o elimina calor latente, no ocurre cambio de temperatura. La entalpía de la vaporización es una función de la presión a la que tiene lugar esa transformación.
Para la condensación, los efectos de calor latente asociados con el cambio de fase son significativos, de manera similar a la ebullición, pero a la inversa. Tenga en cuenta que la entalpía de condensación (o calor de condensación ) es, por definición, igual a la entalpía de vaporización con el signo opuesto. El calor latente es la cantidad de calor agregado o eliminado de una sustancia para producir un cambio de fase. Durante la vaporización, esta energía descompone las fuerzas de atracción intermoleculares, y también debe proporcionar la energía necesaria para expandir el gas (el trabajo pΔV ). Cuando se agrega o elimina calor latente, no ocurre cambio de temperatura. La entalpía de la vaporización es una función de la presión a la que tiene lugar esa transformación.
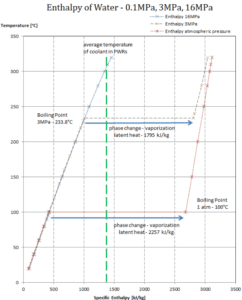
Calor latente de condensación – agua a 0.1 MPa (presión atmosférica)
h lg = – 2257 kJ / kg
Calor latente de condensación – agua a 3 MPa
h lg = – 1795 kJ / kg
Calor latente de condensación – agua a 16 MPa (presión dentro de un presurizador )
h lg = – 931 kJ / kg
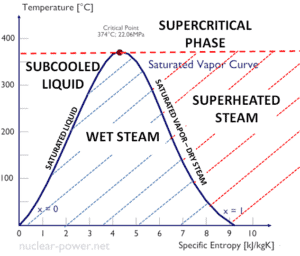
El calor de condensación disminuye al aumentar la presión, mientras que aumenta el punto de ebullición . Se desvanece por completo en un cierto punto llamado punto crítico . Por encima del punto crítico, las fases líquida y de vapor son indistinguibles, y la sustancia se llama fluido supercrítico .
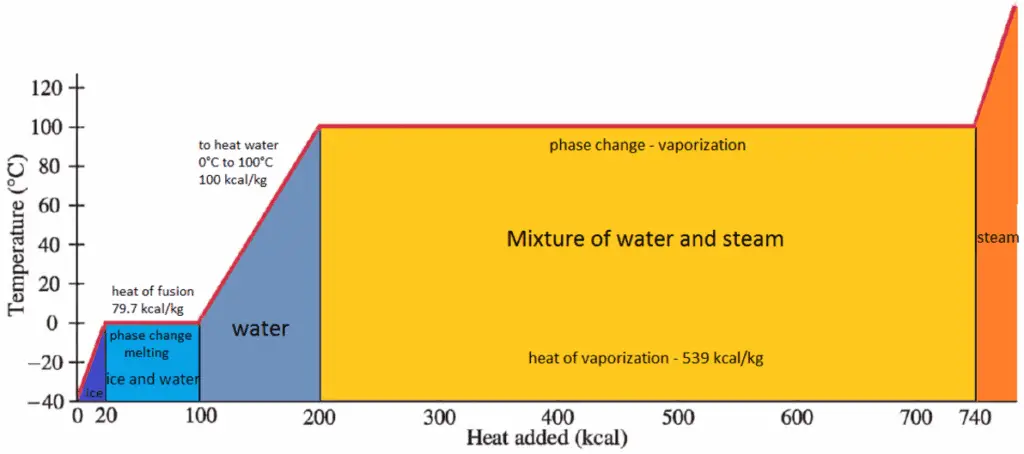
El calor de condensación es el calor liberado para condensar completamente una unidad de vapor saturado y es igual a – h lg = h l – h g .
El calor que es necesario para derretir (o congelar) una unidad de masa en la sustancia a presión constante es el calor de fusión y es igual a h sl = h l – h s , donde h s es la entalpía del sólido saturado y h l Es la entalpía del líquido saturado.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.