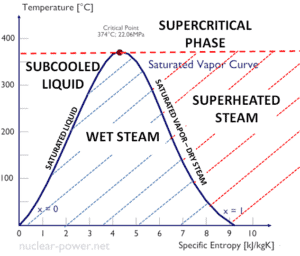
 Pour la condensation, les effets de chaleur latente associés au changement de phase sont importants, de la même manière que pour l’ébullition, mais en sens inverse. Notez que l’ enthalpie de condensation (ou chaleur de condensation ) est par définition égale à l’enthalpie de vaporisation avec le signe opposé. La chaleur latente est la quantité de chaleur ajoutée à une substance ou retirée de celle-ci pour produire un changement de phase. Lors de la vaporisation, cette énergie décompose les forces d’attraction intermoléculaires et doit également fournir l’énergie nécessaire à la détente du gaz ( travail pΔV ). Lorsque de la chaleur latente est ajoutée ou supprimée, aucun changement de température ne se produit. L’enthalpie de vaporisation est fonction de la pression à laquelle se produit cette transformation.
Pour la condensation, les effets de chaleur latente associés au changement de phase sont importants, de la même manière que pour l’ébullition, mais en sens inverse. Notez que l’ enthalpie de condensation (ou chaleur de condensation ) est par définition égale à l’enthalpie de vaporisation avec le signe opposé. La chaleur latente est la quantité de chaleur ajoutée à une substance ou retirée de celle-ci pour produire un changement de phase. Lors de la vaporisation, cette énergie décompose les forces d’attraction intermoléculaires et doit également fournir l’énergie nécessaire à la détente du gaz ( travail pΔV ). Lorsque de la chaleur latente est ajoutée ou supprimée, aucun changement de température ne se produit. L’enthalpie de vaporisation est fonction de la pression à laquelle se produit cette transformation.
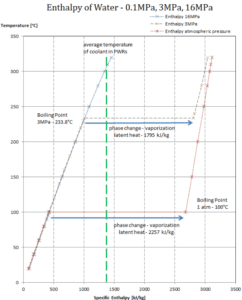
Chaleur de condensation latente – eau à 0,1 MPa (pression atmosphérique)
h lg = – 2257 kJ / kg
Chaleur de condensation latente – eau à 3 MPa
h lg = – 1795 kJ / kg
Chaleur latente de condensation – eau à 16 MPa (pression à l’intérieur d’un pressuriseur )
h lg = – 931 kJ / kg
La chaleur de condensation diminue avec l’augmentation de la pression, tandis que le point d’ébullition augmente. Il disparaît complètement à un certain point appelé le point critique . Au-dessus du point critique, les phases liquide et vapeur ne peuvent pas être distinguées et la substance est appelée fluide supercritique .
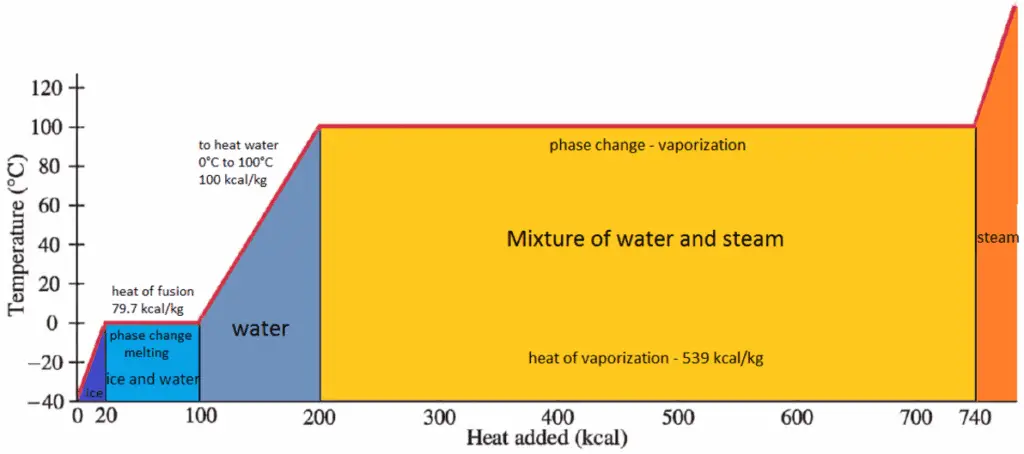
La chaleur de condensation est la chaleur dégagée pour condenser complètement une unité de vapeur saturée et égale à – h lg = h l – h g .
La chaleur nécessaire pour fondre (ou congeler) une unité de masse à la substance à pression constante est la chaleur de fusion et est égale à h sl = h l – h s , où h s est l’enthalpie du solide saturé et h l est l’enthalpie du liquide saturé.
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci