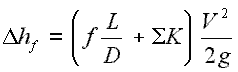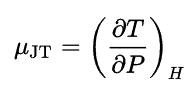Proceso de estrangulamiento – Proceso Isenthalpic
Un proceso de estrangulamiento es un proceso termodinámico , en el cual la entalpía del gas o medio permanece constante (h = constante) . De hecho, el proceso de aceleración es uno de los procesos isentálpicos . Durante el proceso de aceleración, no se realiza ningún trabajo en el sistema (dW = 0) y, por lo general, no hay transferencia de calor ( adiabático ) desde o hacia el sistema (dQ = 0). Por otro lado, el proceso de estrangulamiento no puede ser isentrópico, es un proceso fundamentalmente irreversible . Características del proceso de estrangulamiento:
- Sin transferencia de trabajo
- Sin transferencia de calor
- Proceso irreversible
- Proceso ilealpico
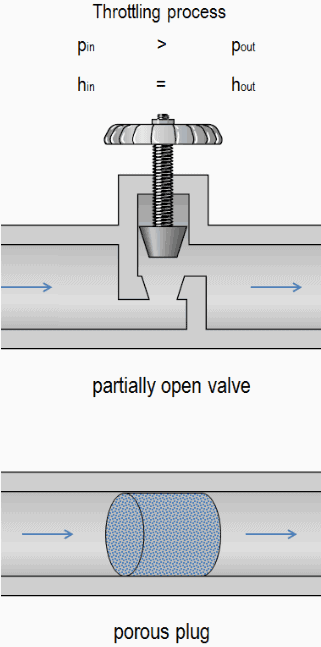
Un estrangulamiento del flujo causa una reducción significativa en la presión , porque un dispositivo de estrangulamiento causa una pérdida de presión local . Se puede lograr un estrangulamiento simplemente introduciendo una restricción en una línea a través de la cual fluye un gas o líquido. Esta restricción se realiza comúnmente mediante una válvula parcialmente abierta o un tapón poroso. Dichas pérdidas de presión generalmente se denominan pérdidas menores , aunque a menudo representan una parte importante de la pérdida de carga . Las pérdidas menores son más o menos proporcional a la cuadrado de la velocidad de flujo y por lo tanto puede ser fácil integrados en la ecuación de Darcy-Weisbach a través de coeficiente de resistencia K .
Por ejemplo, considere la aceleración de un gas ideal que fluye a través de una válvula que está parcialmente abierta. Por experiencia podemos observar que: p in > p out , v in <v out , donde p es la presión y v es el volumen específico . También podemos observar que las entalpías específicas siguen siendo las mismas, es decir, h in = h out .
La entalpía específica es igual a la energía interna específica del sistema más el producto de presión y volumen específico .
h = u + pv
Por lo tanto, si la presión disminuye, el volumen específico debe aumentar si la entalpía debe permanecer constante (suponiendo que u sea constante). Debido a que el flujo de masa es constante, el cambio en el volumen específico se observa como un aumento en la velocidad del gas , y esto también se verifica mediante observaciones.
Si hay un cambio en la energía interna, u, entonces debe haber un cambio de temperatura . Normalmente la temperatura del fluido caerá. Sin embargo, en casos especiales, la temperatura puede permanecer igual o puede aumentar.
Se puede usar una válvula parcialmente abierta o un tapón poroso para reducir la presión en un sistema.
Efecto Joule – Thomson – Coeficiente Joule Thomson
Los cambios de temperatura durante el proceso de regulación están sujetos al efecto Joule-Thomson . A temperatura ambiente y presiones normales, todos los gases, excepto el hidrógeno y el helio, se enfrían durante la expansión del gas. El enfriamiento ocurre porque se debe trabajar para superar la atracción de largo alcance entre las moléculas de gas a medida que se alejan. El efecto depende del valor del coeficiente de Joule-Thomson , que se define como:
Una aplicación del proceso de estrangulamiento ocurre en refrigeradores de compresión de vapor, donde se usa una válvula de estrangulamiento para reducir la presión y reducir la temperatura del refrigerante desde la presión en la salida del condensador hasta la presión más baja existente en el evaporador.
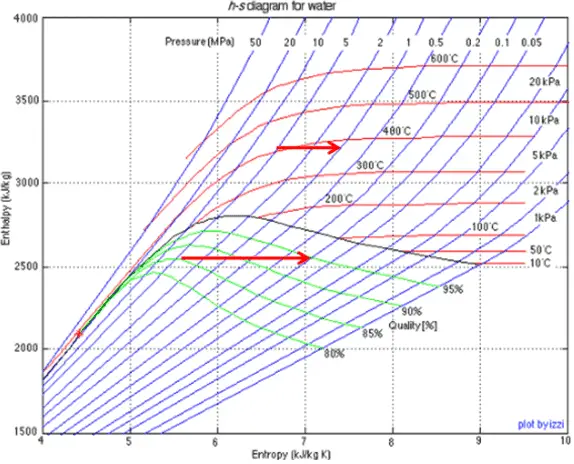
Estrangulamiento de vapor húmedo
El vapor húmedo se caracteriza por la calidad del vapor , que varía de cero a la unidad – intervalo abierto (0,1). El estrangulamiento del vapor húmedo también se asocia con la conservación de la entalpía . La entalpía se conserva porque el sistema no realiza ningún trabajo en el sistema (dW = 0) y, por lo general, no hay transferencia de calor (adiabático) desde o hacia el sistema (dQ = 0). Pero en este caso, una reducción en la presión provoca un aumento en la calidad del vapor . A medida que la presión cae, parte del líquido en el vapor húmedo se vaporiza y aumenta la calidad del vapor (es decir, la fracción de sequedad). Este proceso tiene lugar porque la temperatura de saturaciónes más bajo a la presión más baja. La temperatura más baja, la presión más baja y el vapor de mayor calidad contienen la misma entalpía que el vapor original.
Ejemplo: estrangulamiento del vapor húmedo
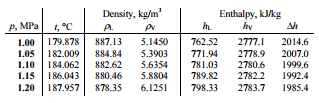
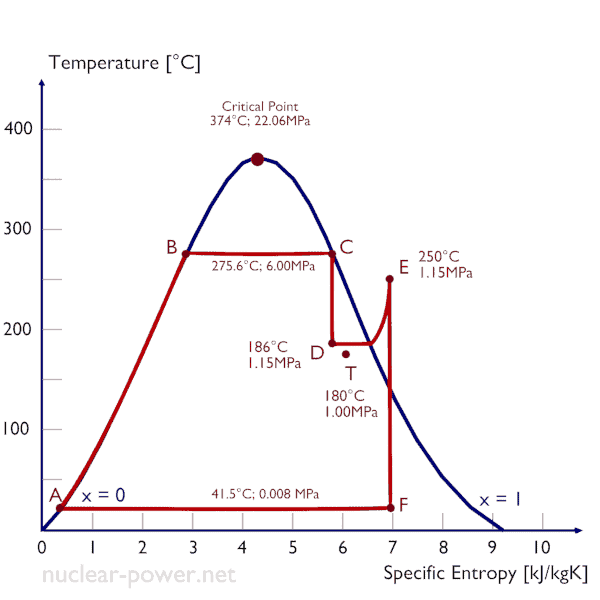
Una etapa de alta presión de la turbina de vapor funciona en estado estable con condiciones de entrada de 6 MPa, t = 275.6 ° C, x = 1 (punto C). El vapor sale de esta etapa de la turbina a una presión de 1,15 MPa, 186 ° C yx = 0,87 (punto D). Determine la calidad del vapor del vapor cuando se estrangula de 1.15 MPa a 1.0 MPa. Suponga que el proceso es adiabático y que el sistema no realiza ningún trabajo.
Ver también: Tablas de vapor
Solución:
La entalpía para el estado D debe calcularse utilizando la calidad del vapor:
h D, húmedo = h D, vapor x + (1 – x) h D, líquido = 2782. 0.87 + (1 – 0.87). 790 = 2420 + 103 = 2523 kJ / kg
Dado que es un proceso isentálpico, conocemos la entalpía para el punto T. De las tablas de vapor tenemos que encontrar la calidad del vapor usando la misma ecuación y resolviendo la ecuación para la calidad del vapor, x:
h T, húmedo = h T, vapor x + (1 – x) h T, líquido
x = ( h T, húmedo – h T, líquido ) / ( h T, vapor – h T, líquido ) = (2523 – 762) / (2777 – 762) = 0.874 = 87.4%
En este caso del proceso de estrangulamiento (1.15MPa a 1MPa) la calidad del vapor aumenta de 87% a 87.4% y la temperatura disminuye de 186 ° C a 179.9 ° C.
El estrangulamiento del vapor húmedo generalmente causa un aumento en la calidad del vapor, un aumento en la entropía y una disminución de la temperatura.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.