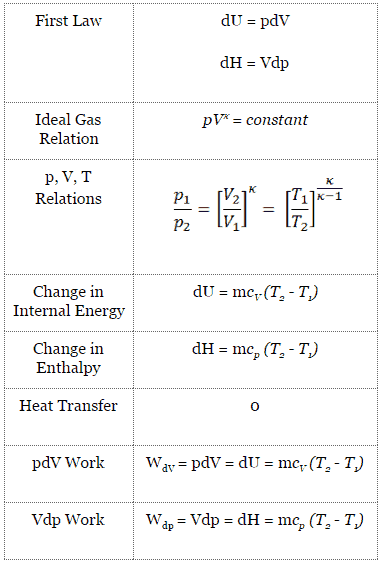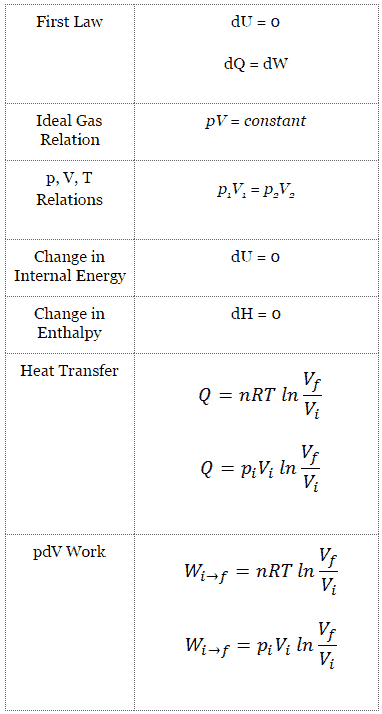Procesos termodinámicos.
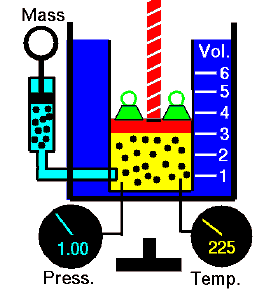
 Un proceso termodinámico se define como un cambio de un macroestado de equilibrio a otro macroestado. Los estados inicial y final son los elementos definitorios del proceso. Durante dicho proceso, un sistema comienza desde un estado inicial i , descrito por una presión p i , un volumen V i y una temperatura Ti , pasa a través de varios estados cuasiestáticos a un estado final f , descrito por una presión p f , a volumen V f , y una temperatura T f . En este procesola energía se puede transferir de forma o al sistema y también se puede trabajar por el sistema o en él. Un ejemplo de un proceso termodinámico es aumentar la presión de un gas mientras se mantiene una temperatura constante. En la siguiente sección, hay ejemplos de procesos termodinámicos que son de suma importancia en la ingeniería de motores térmicos .
Un proceso termodinámico se define como un cambio de un macroestado de equilibrio a otro macroestado. Los estados inicial y final son los elementos definitorios del proceso. Durante dicho proceso, un sistema comienza desde un estado inicial i , descrito por una presión p i , un volumen V i y una temperatura Ti , pasa a través de varios estados cuasiestáticos a un estado final f , descrito por una presión p f , a volumen V f , y una temperatura T f . En este procesola energía se puede transferir de forma o al sistema y también se puede trabajar por el sistema o en él. Un ejemplo de un proceso termodinámico es aumentar la presión de un gas mientras se mantiene una temperatura constante. En la siguiente sección, hay ejemplos de procesos termodinámicos que son de suma importancia en la ingeniería de motores térmicos .
Tipos de procesos termodinámicos
Proceso reversible
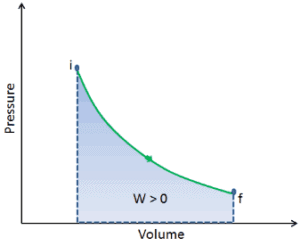
En termodinámica, un proceso reversible se define como un proceso que se puede revertir induciendo cambios infinitesimales en alguna propiedad del sistema, y al hacerlo no deja cambios ni en el sistema ni en el entorno. Durante el proceso reversible, la entropía del sistema no aumenta y el sistema está en equilibrio termodinámico con su entorno.
Proceso irreversible
En termodinámica, un proceso irreversible se define como un proceso que no se puede revertir, proceso, que no puede devolver tanto el sistema como el entorno a sus condiciones originales.
Durante el proceso irreversible aumenta la entropía del sistema .
Proceso cíclico
Un proceso que finalmente devuelve un sistema a su estado inicial se denomina proceso cíclico . Al final de un ciclo, todas las propiedades tienen el mismo valor que tenían al principio. Para tal proceso, el estado final es el mismo que el estado inicial , por lo que el cambio total de energía interna debe ser cero.
Debe tenerse en cuenta que, de acuerdo con la segunda ley de la termodinámica , no todo el calor proporcionado a un ciclo puede transformarse en una cantidad igual de trabajo, debe producirse un cierto rechazo de calor . La eficiencia térmica , η º , de cualquier motor térmico como la relación entre el trabajo que hace, W , para el calor de entrada a la alta temperatura, Q H . η º = W / Q H .
Ver también: Proceso reversible
Ver también: proceso irreversible
Ver también: proceso cíclico
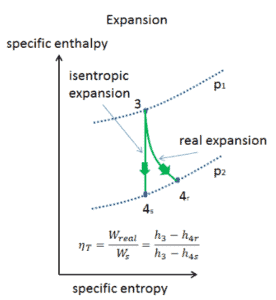
Proceso isentrópico
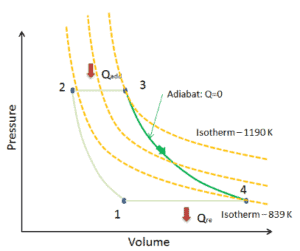
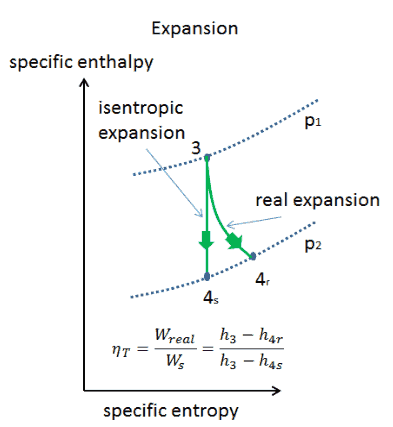
Un proceso isentrópico es un proceso termodinámico , en el cual la entropíadel fluido o gas permanece constante. Significa que el proceso isentrópico es un caso especial de un proceso adiabático en el que no hay transferencia de calor o materia. Es un proceso adiabático reversible . Un proceso isentrópico también se puede llamar un proceso de entropía constante. En ingeniería, un proceso tan idealizado es muy útil para la comparación con procesos reales.
Ver también: proceso isentrópico
Proceso adiabático
Un proceso adiabático es un proceso termodinámico , en el que no hay transferencia de calor dentro o fuera del sistema (Q = 0). El sistema puede considerarse perfectamente aislado . En un proceso adiabático, la energía se transfiere solo como trabajo. La suposición de que no hay transferencia de calor es muy importante, ya que podemos usar la aproximación adiabática solo en procesos muy rápidos . En estos procesos rápidos, no hay tiempo suficiente para que la transferencia de energía como calor tenga lugar hacia o desde el sistema.
En dispositivos reales (como turbinas, bombas y compresores) se producen pérdidas de calor y pérdidas en el proceso de combustión, pero estas pérdidas suelen ser bajas en comparación con el flujo de energía general y podemos aproximar algunos procesos termodinámicos por el proceso adiabático.
Ver también: proceso adiabático
Proceso isotérmico
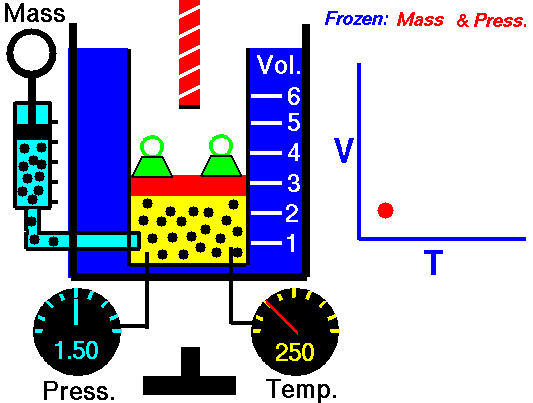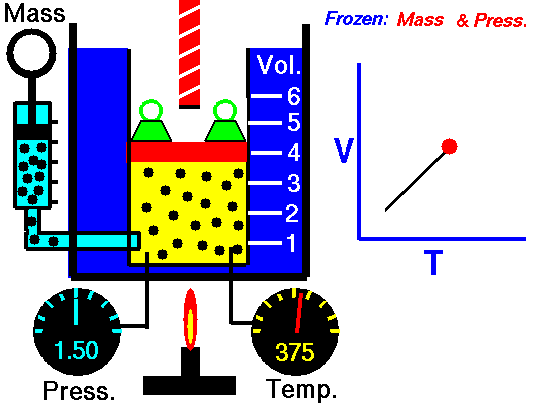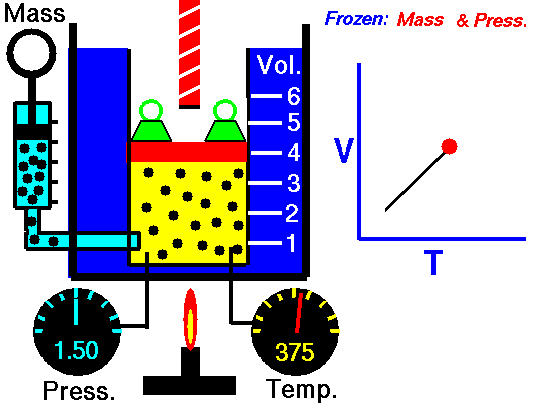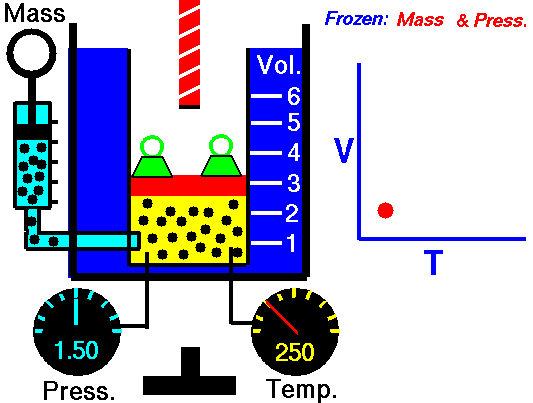
Un proceso isotérmico es un proceso termodinámico , en el que la temperatura del sistema permanece constante (T = constante). La transferencia de calor dentro o fuera del sistema generalmente debe ocurrir a una velocidad tan lenta para ajustarse continuamente a la temperatura del depósito a través del intercambio de calor. En cada uno de estos estados se mantiene el equilibrio térmico .
Para un proceso ideal de gasy politrópico, el caso n = 1 corresponde a un proceso isotérmico (temperatura constante). A diferencia del proceso adiabático , en el que n = κ y un sistema no intercambia calor con su entorno (Q = 0; ∆T ≠ 0 ) , en un proceso isotérmico no hay cambio en la energía interna (debido a ∆T = 0 ) y, por lo tanto, ΔU = 0 (para gases ideales) y Q ≠ 0. Un proceso adiabático no es necesariamente un proceso isotérmico, ni un proceso isotérmico es necesariamente adiabático.
Ver también: proceso isotérmico

Proceso isobárico
Un proceso isobárico es un proceso termodinámico , en el cual la presión del sistema permanece constante (p = const). La transferencia de calor dentro o fuera del sistema funciona, pero también cambia la energía interna del sistema.
Dado que hay cambios en la energía interna (dU) y cambios en el volumen del sistema (∆V), los ingenieros a menudo usan la entalpía del sistema, que se define como:
H = U + pV
En muchos análisis termodinámicos es conveniente utilizar la entalpía en lugar de la energía interna. Especialmente en el caso de la primera ley de la termodinámica .
En ingeniería, ambos ciclos termodinámicos muy importantes (ciclo de Brayton y Rankine ) se basan en dos procesos isobáricos , por lo tanto, el estudio de este proceso es crucial para las centrales eléctricas.
Ver también: proceso isobárico
Proceso isocorico
Un proceso isocróricoes un proceso termodinámico, en el que el volumen del sistema cerrado permanece constante (V = constante). Describe el comportamiento del gas dentro del contenedor, que no puede deformarse. Dado que el volumen permanece constante, la transferencia de calor dentro o fuera del sistema no funciona con el p∆V , sino que solo cambia la energía interna (la temperatura) del sistema.
En la ingeniería de motores de combustión interna , los procesos isocróricos son muy importantes para sus ciclos termodinámicos (ciclo Otto y Diesel), por lo tanto, el estudio de este proceso es crucial para la ingeniería automotriz.
Ver también: proceso isocrórico
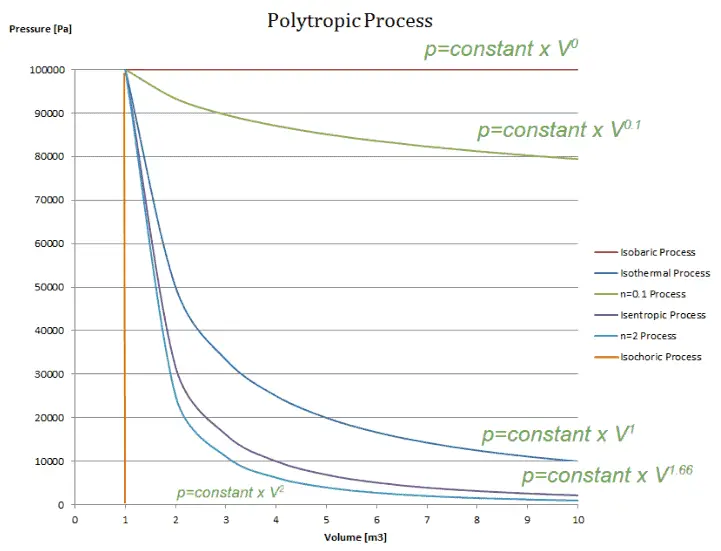
Proceso politropico
Un proceso politrópico es cualquier proceso termodinámico que se puede expresar mediante la siguiente ecuación:
pV n = constante
El proceso politrópico puede describir la expansión y compresión del gas, que incluyen la transferencia de calor . El exponente n se conoce como índice politrópico y puede tomar cualquier valor de 0 a ∞, dependiendo del proceso en particular.
Ver también: proceso politrópico
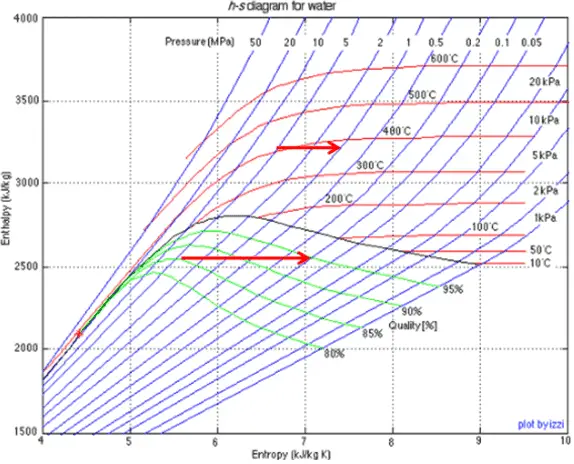
Proceso de estrangulamiento – Proceso Isenthalpic
Un proceso de estrangulamiento es un proceso termodinámico , en el cual la entalpía del gas o medio permanece constante (h = constante) . De hecho, el proceso de aceleración es uno de los procesos isentálpicos . Durante el proceso de aceleración, no se realiza ningún trabajo en el sistema (dW = 0) y, por lo general, no hay transferencia de calor ( adiabático ) desde o hacia el sistema (dQ = 0). Por otro lado, el proceso de estrangulamiento no puede ser isentrópico, es un proceso fundamentalmente irreversible . Características del proceso de estrangulamiento:
- Sin transferencia de trabajo
- Sin transferencia de calor
- Proceso irreversible
- Proceso Isenthalpic
El estrangulamiento del vapor húmedo también se asocia con la conservación de la entalpía . Pero en este caso, una reducción en la presión provoca un aumento en la calidad del vapor .
Ver también: Proceso de regulación
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.